
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электропроводность. Электропроводность проводников второго рода
|
|
|
|
Стадия истощения.
Стадия истощения характеризуется истощением адаптационных резервов, снижением работоспособности человека, снижением резистентности к воздействию неблагоприятных факторов, возникно-вением различных заболеваний. Характер возникающих заболеваний в этой ситуации определяется наиболее уязвимыми, слабыми звеньями организма человека. В одних случаях это может быть невроз, в других случаях гипертоническая болезнь или язвенная болезнь. Проявлением стадии истощения может быть так называемый синдром хронической усталости. Этот синдром проявляется в резком снижении работоспособности, нарушении сна, исчезновении аппетита, нарастании тревожности.
Для уменьшения последствий стресса для организма необходимо использовать ряд рекомендаций:
1. При длительном стрессе стремиться прекратить действие неблагоприятного фактора.
2. Помнить, что универсальным «лекарством» при стрессе является дозированная, индивидуально ориентированная двигательная активность.
3. Для ускорения формирования стадии резистентности использовать адаптогены – группу препаратов растительного и животного происхождения (экстракт корня женьшеня, препараты китайского лимонника, различные продукты пчеловодства, пантокрин и др). Указанные препараты можно использо-вать после консультаций со специалистами – медиками.
Необходимо помнить, что одним из наиболее неблагоприятных стрессогенных факторов современного мира является сочетание высокой потребности в чем-то, необходимости для достижения поставленной цели переработки большого количества информации и дефицита времени, отпущенного на переработку этой информации. Это неблагоприятное сочетание может преследовать нас всю жизнь, вызывая стрессовые реакции организма, провоцировать возникновение тех или иных заболеваний. Экзаменационная сессия в высших учебных заведениях является естественной моделью такой ситуации. Для того, чтобы она не стала для вас стрессовой, необходимо, с одной стороны, находить больше времени для обучения, систематически изучать тот или иной предмет (снять фактор дефицита времени), с другой стороны, помнить об антистрессовой роли регулярной, дозированной физической активности.
Электрохимия представляет собой раздел физической химии, изучающий превращение химической энергии в электрическую, и наоборот.
Первый тип реакций осуществляется в гальванических элементах, в которых энергия химической реакции превращается в электрическую энергию, второй тип – в электролизерах, в которых электрическая энергия превращается в химическую.
Одно из основных понятий электрохимии – электропроводность.
Электропроводностью называют способность веществ проводить электрический ток. Электропроводность L обозначает величину, обратную сопротивлению проводника тока:
L = 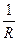 (ом –1) (6.1)
(ом –1) (6.1)
В проводниках второго рода (растворы и расплавы электролитов) электричество переносится ионами. Скорость движение ионов в растворах по сравнению со скоростью движения электронов в металлах мала, поэтому неудивительно, что электропроводность, например Аg и Си, приблизительно в 1000 000 раз больше электропроводности растворов.
Между электрическими свойствами металлов (их относят к проводникам 1 рода) и расплавов или растворов электролитов (проводники 11 рода) имеются существенные различия.
Таблица 6.1. Сравнение электрических свойств металлов и расплавов или растворов электролитов
| Свойство | Для металла | Для расплава или раствора электролита |
| Носители электрического заряда. Проводимость. Изменение проводимости при повышении температуры. Изменение вещества при протекании электрического тока. | Электроны Очень хорошая Уменьшается Нет | Ионы Незначительная Увеличивается Различается |
29.2. Стандартные электродные потенциалы металлов.
В 1865 г. (т.е. за 4 года до открытия Д.И. Менделеевым периодического закона) металлы уже были классифицированы по их активности. Это сделал известный русский ученый Н.Н. Бекетов, который изучал действие различных металлов на разбавленные кислоты и воду и заметил, что наиболее активно ведут себя щелочные металлы. Некоторые металлы, такие как Cи, Hg, Ag, Au, вообще не вытесняли водород из растворов кислот, даже наоборот – водород сам был способен вытеснят металлы из солей ртути и серебра.
Итого трудов Н.Н. Бекетова явился так называемый вытеснительный ряд металлов:
К, Na, Са, Mg, Al, Mn, Zn, Fe, Ni, Sn, Pb,H2, Cи, Hg, Ag, Au.
Все металлы, стоящие в этом ряду левее водорода, вытесняют водород из разбавленных кислот.
Современное название этого ряда - «Электрохимический ряд напряжений», так как положение каждого металла в этом ряду определяется величиной так называемого электродного потенциала. (Напомним, что электрическим потенциалом называют величину, соответствующую энергии, которую нужно затратить (положительный потенциал) или которую можно получить (отрицательный потенциал) при переносе единицы электричества из бесконечности в данную точку).
Что же такое электродный потенциал? Как он возникает?
Согласно современным представлениям в узлах кристаллических решеток металлов находятся атомы и ионы, причем нейтральных атомов очень мало, подавляющее число частиц находится в виде ионов. Электроны, подчиняясь законам квантовой теории, движутся в поле положительных зарядов, создавая своеобразный «электронный газ». Таким образом, в металле существует подвижное равновесие, которое можно выразить уравнением:
Me ↔ Mez+ + z e. (6.2.)
Если погрузить пластинку металла в воду, то под действием полярных молекул воды часть катионов перейдет в жидкость, а электроны останутся на пластинке металла, в результате чего металл зарядится отрицательно:
Me Z+ + т Н2О ↔[ Me (Н2О m)]Z+. (6.3.)
в кристалле в растворе
металла
Сложив уравнение (6.2.) и (6.3.), получим суммарное уравнение, отражающее процесс диссоциации атомов металла под действием полярных молекул воды:
Me + т Н2О ↔[ Me (Н2О т)]Z+ + z e-
в растворе в кристалле
металла
Катионы, перешедшие в жидкость, располагаются вблизи поверхности отрицательно заряженной пластинки металла, в результате чего образуется двойной электрический слой, что схематически можно представить так:
| _ _ _ Металл _ _ _ _ | + + + + Вода + + + |
На этой схеме двойной электрический слой имеет плоское строение, подобно конденсатору, одна обкладка которого расположена на поверхности металла, а вторая – в прилегающем слое жидкости. В действительности же слой ионов под действием двух противоположно направленных сил (электростатического притяжения со стороны металла и теплового движения) имеет диффузное строение, т.е. он проникает в жидкость на некоторую глубину.
Следует отметить, что изучение двойного электрического слоя имеет существенное значение для понимания таких практически важных процессов, как электролиз, электрохимические реакции в гальванических элементах, коагуляция коллоидов, флотация и др.
При процессах выплавки металлов двойной электрический слой возникает на границе между жидким металлом и расплавленным шлаком. Его существование может оказывать влияние на процессы распределения веществ (в частности, примесей) между этими средами.
В разработке современной теории двойного электрического слоя на границе раздела твердая фаза – жидкость ведущая роль принадлежит российским ученым, главным образом академику А.Н.Фрумкину и его школе.
Таким образом, на месте соприкосновения жидкости с металлом возникает определенная разность потенциалов (так называемый скачок потенциала). Ясно, что чем активнее металл, тем легче будут диссоциировать его атомы под действием полярных молекул воды и тем, следовательно, большим будет отрицательный заряд металла, что, в свою очередь, обусловит бǿльшую разность потенциалов на границе металл – жидкость.
Процесс перехода ионов металла в жидкость является обратимым процессом. Поэтому, если погрузить пластинку металла не в воду, а в раствор соли этого металла, то равновесие будет смещено: из металла в раствор будет переходить меньше ионов и разность потенциалов на границе металл-раствор будет несколько иной, чем в первом случае.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 892; Нарушение авторских прав?; Мы поможем в написании вашей работы!