
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
ЭДС гальванических элементов. Уравнение Нернста
|
|
|
|
Электродвижущую силу любого гальванического элемента можно вычислить по разности стандартных потенциалов. При этом надо из более положительного потенциала вычитать менее положительный (так как электродвижущая сила - всегда положительная величина).
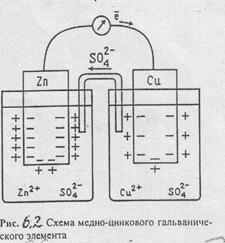 Цепь гальванического элемента принято записывать так, чтобы отрицательный электрод (т.е. анод) располагался слева, а положительный (т.е. катод) – справа.
Цепь гальванического элемента принято записывать так, чтобы отрицательный электрод (т.е. анод) располагался слева, а положительный (т.е. катод) – справа.
Рассмотрим, например, медно-цинковый элемент (элемент Даниэля-Якоби), рис. (6.2).
Если замкнуть цепь медно-цинкового элемента, то электроны начнут перемещаться от цинкового электро-да к медному, ибо цинк является отрицательным электродом (Eo Zn/Zn2+= -0,76В), а медь – положительным (E0 Cu/Cu2+ =
= + 0,34В). (Иначе говоря, концентрация электронов на цинковой пластинке больше, чем на медной пластинке, а электроны самопроизвольно могут переходить только от электродов с более высокой концентрацией электронов на электроды с белее низкой концентрацией электронов). Поэтому схему этой цепи следует записать так:
(-) Zn | ZnSO4 | | CuSO4 | Cu (+).
На аноде будет идти процесс окисления атомов цинка:
Zn – 2е = Zn2+;
на катоде – восстановление ионов меди:
Cu2+ + 2e = Cu.
Таким образом, в левом полуэлементе будет увеличиваться концентрация катионов Zn2+, в правом – концентрация анионов SO42-, поэтому часть анионов будет переходить из правого полуэлемента в левый (за счет сил электростатического притяжения). ЭДС этого элемента будет равна
Eo = φoCu2+/Cu - φoZn2+/Zn = 0,34 – (- 076) = 1,10 В.
Величина потенциала металла зависит от температуры и от концентрации ионов металла в растворе. Математически эта зависимость определяется уравнением Нернста:
φ = φо + 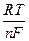 InC, (6.4.)
InC, (6.4.)
где φ – потенциал металла при данной концентрации его ионов, В;
φо- стандартный электродный потенциал металла, В; R – универсальная газовая постоянная, равная 8,31 Дж/(моль К); Т–абсолютная температура, К; F-число Фарадея, равное 96500 Кл/моль е; n-число молей электронов, участвующих в процессе; С – концентрация ионов металла в растворе, моль/л.
Если в формулу Нернста подставить числовые значения констант R и F и перейти от натуральных логарифмов к десятичным (In N = 2,303 Ig N), то при 298 К получим
2,3 RT/F ≈ 0,059,
откуда
φ = φо + 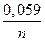 IgC. (6.5.)
IgC. (6.5.)
Например, если в том же медно-цинковом элементе СCu2+ = 1,5 моль/л,
СZn2+ = 0,01 моль/л, то потенциал медного электрода
φoCu2+/Cu = 0,34 +  Ig 1,5 = 0,35 В,
Ig 1,5 = 0,35 В,
а потенциал цинкового электрода
φZn2+/Zn = -0,76 +  Ig 0,01 = -0,82 В,
Ig 0,01 = -0,82 В,
откуда ЭДС = 0,35 – (-0,82) = 1,17 В, т.е. возросла на 0,07 В.
Таким образом, при увеличении концентрации раствора электродный потенциал увеличивается. Точно так же действует и увеличение температуры.
Можно составить гальванический элемент из одинаковых электродов, погруженных в раствор собственной соли с различными концентрациями. Электрический ток в цепи такого концентрационного элемента получается за счет выравнивания концентраций раствора в обоих полуэлементах. Примером концентрационной цепи может служить цепь
(-) Ag | AgNO3(C1) || AgNO3(C2) | Ag (+),
где С1< C2.
Поскольку в электродном процессе участвует только один электрон (Ag/Ag+), а величина φo для обоих электродов одинакова, то для ЭДС данного элемента получим следующее выражение:
E = φ2 - φ1 = 0,059 Ig.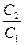 (6.6.)
(6.6.)
Ясно, что ЭДС концентрационных элементов невелика, и ток в цепи протекает только до момента выравнивания концентраций раствора в обоих полуэлементах.
При помощи гальванического элемента совершается электрическая работа за счет энергии химической реакции. Если на электродах испытывает превращение 1 моль вещества, то по закону Фарадея через систему протекает количество электричества, равное nF, где n – число молей эквивалентов в одном моле вещества. Таким образом, максимальная электрическая работа гальванического элемента при превращении одного моля вещества Wм.,э равна
Wм.,э = nFEэ , (6.7)
где Eэ – ЭДС гальванического элемента.
В то же время максимальная полезная работа Wм.,р, которую может совершить система при протекании реакции при постоянном давлении, равна энергии Гиббса реакции:
Wм.,р = - ΔG. (6.8)
Так как Wм.,р = Wм.,э, то, приравнивания правые части уравнений (6.7) и (6.8), получаем
Еэ = - [ΔG / (nF)]. (6.9)
Таким образом, при известных значениях энергии Гиббса реакции ΔG можно рассчитать Еэ и, наоборот. Уравнение (6.9) показывает связь между химической и электрической энергиями. Энергия Гиббса реакции зависит от активностей a или парциальных давлений р реагентов и продуктлв реакции. Например, для реакции
bB + dD ↔ lL + qQ
энергия Гиббса по уравнению Вант – Гоффа равна
ΔG = ΔG0 – RT ln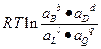 , (6.10а)
, (6.10а)
или
ΔG = ΔG0 – 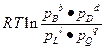 , (6.10б)
, (6.10б)
где ΔG0 – стандартная энергия Гиббса реакции.
Подставляя уравнение (6.10а) в уравнение (6.9), получаем:
Еэ = - 
 (6.11)
(6.11)
При стандартных состояниях, т.е. при активностях реагентов и продуктов реакции, равных единице, имеем
Еэ = - [ΔG / (nF)]= Е0э , (6.12)
где Е0э – стандартная ЭДС гальванического элемента.
Из уравнений (6.11) и (6.12) получаем уравнение для ЭДС элемента
. Еэ = Е0э +  (6.13)
(6.13)
Для газообразных веществ в уравнении (6.13) активности заменяют относительными парциальными давлениями соответствующих веществ. При активностях реагентов и продуктов реакции, равных единице, т.е. при a B = a D = a L = a Q = 1, получаем Еэ = Еоэ. Стандартной называется ЭДС элемента, если парциальные относительные давления исходных веществ и продуктов реакции равны единице или активности исходных веществ и продуктов реакций равны единице. Значение стандартной ЭДС можно вычислить по уравнению (6.12), если известны значения стандартных энергий Гиббса реакции ∆Go. Последние легко рассчитать, зная энергию Гиббса реакций образования продуктов реакции и исходных веществ. В качестве примера запишем уравнение для расчета ЭДС элемента Даниэля – Якоби:
EЭ = Еоэ+ (6.14)
(6.14)
Твердые медь и цинк, участвующие в реакции, являются практически чистыми индивидуальными веществами, активность которых постоянна и равна единице (а т.фазы = 1). Поэтому уравнение (6.14) упрощается:
EЭ = Еоэ + 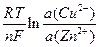
Рассчитаем стандартную ЭДС элемента. Стандартная энергия Гиббса реакции элемента Даниэля – Якоби равна –212,3 кДж/моль = -212,3 кВт.с/моль (см. справочник термодинамических величин). Стандартная ЭДС элемента Даниэля – Якоби при 29
Еэ0 = - 
29.4. Окислительно-восстановительные потенциалы.
В рассмотренных выше гальванических элементах сами электроды участвуют в окислительно-восстановительных реакциях (материал электродов при этом расходуется). Однако могут быть построены и такие гальванические элементы, электроды которых не претерпевают изменений, а являются лишь переносчиками электронов.
Рассмотрим гальванический элемент, схема которого представлена на рис.6.3
Левый полуэлемент представляет собой раствор, содержащий смесь солей олова (11), и олова (1V), в который погружен платиновый электрод. В правом полуэлементе платиновый электрод погружен в раствор смеси солей железа (11) и железа (111). Оба раствора соединены электролитическим ключом (для создания ионной проводимости). Если замкнуть внешнюю цепь, включив в нее гальванометр, то стрелка гальванометра покажет течение электронов от восстановителя (ионы Sn2+) к окислителю (ионы Fe3+).
Таким образом, в левом полуэлементе происходит окисление ионов олова (П): Sn2+ - 2е = Sn4+, и платиновый электрод заряжается отрицательно (анод), в правом полуэлементе происходит восстановление ионов железа (111): Fe3+ + е = Fe2+, и платиновый электрод заряжается положительно (катод).
Продукты окисления (в левом полуэлементе) и восстановления (в правом полуэлементе) остаются в растворе, составляя с исходными веществами окислительно-восстановительные системы (или пары).
Рис.6.3. Схема гальванического элемента Так, в левом полуэлементе
с инертными электродами. окислительно-восстановительной
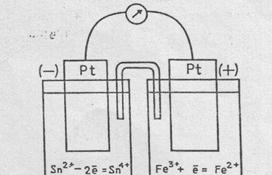 системой (парой) является Sn4+/Sn2+, где Sn4+ - окисленная форма (ставится в числителе), Sn2+- восстановленная форма (ставится в знаменателе). В правом полуэлементе такой системой является
системой (парой) является Sn4+/Sn2+, где Sn4+ - окисленная форма (ставится в числителе), Sn2+- восстановленная форма (ставится в знаменателе). В правом полуэлементе такой системой является
Fe3+/ Fe2+, где в числителе - окисленная форма, в знаменателе – восстановленная форма.
Схему рассмотренного гальванического элемента можно представить так:
(-) Pt, Sn2+ | Sn4- | | Fe3+| Fe2+, Pt (+).
Происходящий в подобных гальванических элементах процесс по существу не отличается от химического процесса, протекающего в медно-цинковом элементе, однако в первом случае металл электрода (платина) играет лишь роль переносчика электронов, тогда как в медно-цинковом элементе электроды сами вступают в реакцию.
Электроды, не участвующие в протекающих на их поверхности окислительно-восстановительных реакциях, а служащие лишь переносчиками электронов, получили название окислительно-восстановительных электродов (или редокс - электродов). Возникающие на этих электродах потенциалы называются окислительно-восстановительными потенциалами (или редокс - потенциалами).Рассматривая окислительно-восстановительный потенциал, следует иметь в виду всю систему, состоящую из окисленной и восстановленной форм.
Величина и знак окислительно-восстановительного потенциала зависят от свойств данной окислительно-восстановительной системы и от отношения концентраций окисленной и восстановленной форм. Количественно эта зависимость определяется уравнением Нернста:
φ = φо + 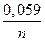 Ig
Ig 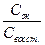 ,
,
где φо – стандартный окислительно-восстановительный потенциал, В; Сок – произведение концентраций (активностей) веществ, соответствующих окисленной форме, моль/л; С восст – произведение концентраций (активностей) веществ, соответствующих восстановленной форме, моль/л.
Например, для полуреакции Fe3+ +е = Fe2+ имеем:
n = 1, Cок = СFe3+, Cвосст = СFe2+.
Для полуреакции Сr2O7 2 - + 14H+ + 6e = 2Cr3+ + 7H2O имеем:
n = 6, Cок = С (Сr2 О7 2-) ۰ C14Н+, Cвосст = С2Cr 3+ ۰ C7H2O.
Но поскольку в разбавленных растворах концентрацию воды можно считать постоянной величиной, то ее включают в величину φо, следовательно,
Свосст = С2Cr.3+
Чем больше величина φ, тем большими окислительными свойствами обладает окисленная форма вещества и тем меньшими восстановительными свойствами обладает восстановленная форма вещества.
Для сравнения потенциалов между собой берут одинаковые концентрации окисленной и восстановленной форм, т.е. Сок / Свосст = 1 (например, каждый по 1 моль/л), тогда φ = φо. В этих условиях потенциал окислительно-восстановительной системы φо, измеренный по отношению к водородному электроду, называется стандартным окислительно-восстановительным потенциалом (или, что то же, стандартным редокс-потенциалом).
Значения стандартных потенциалов φо для многих окислительно-восстановительных систем табулированы и ими пользуются для расчетов ЭДС гальванических элементов, построенных на основе этих реакций, а также для определения направления окислительно-восстановительных реакций.
Для того чтобы определить, осуществим ли на практике тот или иной окислительно-восстановительный процесс, необходимо рассчитать ЭДС этого процесса (пользуясь табличными значениями стандартных окислительно-восстановительных потенциалов φо). Для этого из потенциала предполагаемого окислителя нужно вычесть потенциал предполагаемого восстановителя; если в результате получится положительное значение ЭДС, то данная реакция осуществима, если в результате получится отрицательное значение ЭДС, то данная реакция неосуществима (в этом случае осуществима обратная ей реакция). При ЭДС, равной нулю, имеет место химическое равновесие.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 3913; Нарушение авторских прав?; Мы поможем в написании вашей работы!