
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теория кислотно-основных индикаторов
|
|
|
|
Кислотно-основные индикаторы в кислых растворах имеют различную окраску. Так, лакмус в кислой среде (рН < 7) окрашен в красный цвет, а в щелочной (рН > 7) — в синий; фенолфталеин при рН < 8 бесцветен, а при рН > 9 имеет красную или красно-малиновую окраску; метиловый оранжевый при рН> 4 окрашен в желтый цвет, а в более кислых растворах — в красный.
Для объяснения природы изменения окраски индикаторов при изменении рН раствора предложены различные теории, наиболее известными из которых являются 1)ионная, 2)хромофорная и 3)ионно-хромофорнная.
1) Ионная теория кислотно-основных индикаторов. Эта наиболее ранняя теория была предложена В. Оствальдом (1853 -1932). В рамках данной теории принимается, что кислотно-основные индикаторы представляют собой слабые кислоты или слабые основания, подвергающиеся ионизации в водных растворах, причем нейтральная и ионизированная формы индикатора обладают различной окраской.
Пусть индикатор - слабая кислота НInd. В водном растворе индикатора устанавливается равновесие:
 Hind + H2O H3О+ + Ind-
Hind + H2O H3О+ + Ind-
красный синий
Предположим, что нейтральная молекула индикатора Hind (назовём
ее кислой формой) обладает красной окраской, а анионы Ind- (основная
форма) — синей. При увеличении концентрации ионов водорода (понижении рН раствора) равновесие сместится влево - в сторону кислой
формы индикатора, которая после понижения рН раствора до некоторой
величины будет преобладать в растворе и придаст ему красный цвет. Напротив, при уменьшении концентрации ионов водорода (повышении рН раствора) равновесие сместится вправо - в в сторону основной формы индикатора. После увеличения рН раствора до некоторой величины эта форма будет доминировать в растворе и придаст ему синий цвет.
Аналогичное рассмотрение можно провести и в том случае, когда индикатор - слабое основание.
Недостатки теории.
а) Она констатирует различие окрасок кислой и основной форм, но
не объясняет природы наличия и изменения самой окраски.
б) Она не связывает окраску индикаторов с их строением.
в) Согласно ионной теории, переход одной формы индикатора в другую должен происходить как ионная реакция. Известно, что ионные реакции протекают быстро, практически мгновенно. Однако в целом ряде случаев кислотно-основные индикаторы изменяют свою окраску не мгновенно, а во времени, что не укладывается в рамки ионной теории.
2) Хромофорная теория кислотно-основных индикаторов. В рамках теории принимается, что наличие окраски кислотно-основных индикаторов являющихся органическими соединениями, обусловлено присутствием в молекулах индикаторов хромофорных групп, или хромофopoв. В роли хромофорных групп могут выступать такие группировки атомов и связей, как -N=N-
=C=S
-N=O
 -N=N-
-N=N-
O
хиноидные структуры
В молекулах хромофоров присутствуют ауксохромные группы (амино-, гидрокси-, метоксигруппы и др.), которые сами по себе не придают окраску молекуле органического соединения, но влияют на свойства хромофоров (изменяют оттенок или интенсивность окраски).
Индикаторы в растворе могут присутствовать в разных таутомерных формах, находящихся в равновесии. В кислой среде доминирует одна таутомерная форма индикатора с какой-то хромофорной группой, а в щелочной - другая таутомерная форма индикатора с иной хромофорной группой. Разные хромофорные группы придают неодинаковую окраску таутомерным формам индикатора.
 Так как таутомерные превращения - это внутримолекулярные перегруппировки, которые в отличие от ионных реакций осуществляются медленнее, во времени, поэтому изменение цвете
Так как таутомерные превращения - это внутримолекулярные перегруппировки, которые в отличие от ионных реакций осуществляются медленнее, во времени, поэтому изменение цвете
индикатора происходит не мгновенно, а во времени.
Хромофорная теория объясняет наличие окраски разных форм индикатора и связывает цвет индикатора с его строением.
Однако хромофорная теория обладает рядом недостатков.
а) Она не объясняет, почему таутомерные превращения и изменение окраски индикатора происходят при изменении рН раствора.
б) Во многих случаях (хотя и не всегда) изменение окраски индикатора происходит мгновенно, по типу ионных реакций, что не укладывается в рамки хромофорной теории.
в) Хромофорная теория не поддается количественной трактовке.
3) Ионно-хромофорная теория. Эта теория объединила представления ионной и хромофорной теорий.
В рамках ионно-хромофорной теории принимается, что кислотно-основные индикаторы представляют собой слабые кислоты и основания, причем нейтральная молекула индикатора и ее ионизированная форма содержат разные хромофорные группы. Молекулы индикатора в водном растворе способны либо отдавать ионы водорода (индикатор — слабая кислота), либо принимать их (индикатор — слабое основание), подвергаясь при этом таутомерным превращениям.
Пусть индикатор представляет собой слабую одноосновную кислоту
HInd, при этом Hind – I таутомерная форма, слабая кислота, HindB – II таутомерная форма. В соответствии с ионно-хромофорной теорией в водном растворе
индикатора устанавливается равновесие:
Hind ↔ Н+ + Ind- ↔ HindB ↔ H+ + Ind-B
кислая форма I основная форма II
Кислая форма I индикатора представляет собой нейтральную молекулу слабой кислоты HInd в какой-то таутомерной форме. Основная форма IndB- - это анион кислотной формы HindB-, которая является сильной кислотой в другой таутомерной форме, отличающейся от таутомерной формы слабой кислоты HInd. Поскольку HIndB - сильная кислота, то концентрация ее недиссоциированной формы в растворе ничтожно мала. Таутомерная форма аниона IndB- соответствует таутомерной форме HindB, т.е. также отличается от таутомерной формы HInd. Хромофорные группы обеих таутомерных форм Hind и IndB- неодинаковы, поэтому и окраска этих двух форм различна.
При подкислении раствора (понижении его рН) равновесие смещается влево - в сторону кислой формы I и после понижения рН до такого значения рН1, когда в растворе доминирует эта форма, раствор принимает окраску формы I.
Напротив, при уменьшении концентрации ионов водорода (увеличении рН раствора) равновесие смещается вправо - в сторону основной формы II и после повышения рН до некоторого значения рН2, когда в растворе доминирует уже форма II, раствор принимает окраску формы II.
Таким образом, в интервале изменения рН раствора от рН1 до рН2 наблюдается переход окраски индикатора из одной в другую.
Интервал изменения (перехода) окраски индикатора. Из изложенного выше следует, что для каждого кислотно-основного индикатора существует такой интервал изменения рН раствора, в котором происходит изменение окраски индикатора.
Интервал перехода кислотно-основного индикатора — это область концентрации ионов водорода, в пределах которой глаз способен обнаружить изменение в оттенке, интенсивности окраски визуального индикатора, вызванное изменением соотношения двух соответствующих форм индикатора.
Hind ↔ H+ + Ind⁻B
[H+]* [Ind⁻B]
 Ka=
Ka=
[Hind]
Ka*[Hind]
 H+=
H+=
[Ind⁻B]
lg[H+] = lgKa + lg[Hind] - lg[Ind⁻B]
-lg[H+] = -lgKa - lg[Hind] + lg[Ind⁻B]
[Ind⁻B]
 pH = pKa + lg
pH = pKa + lg
[Hind]
или
[Hind]
 pH = pKa – lg
pH = pKa – lg
[Ind⁻B]
Из формулы следует, что pH раствора индикатора зависит от:
1) pKa индикатора
2) от отношения концентраций разных форм индикатора разного цвета
Если интенсивность обеих форм индикатора одинакова, то глаз человека воспринимает окраску доминирующей формы индикатора, если концентрация этой формы в 10 раз превышает концентрацию другой формы.
Таким образом, граничное условие при котором раствор принимает окраску формы Hind
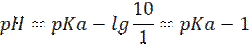
Граничное условие, при котором раствор принимает окраску формы Ind⁻B
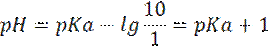
Объединяя эти 2 условия получаем:
pH = pKa±1 (1)
Введем обозначение рТ = pKa и назовем его показателем титрования индикатора. Тогда окончательно получим выражение для интервала перехода окраски индикатора:
или
рH = рТ ± 1 = pKa ± 1 (2)
Полученное уравнение позволяет оценить интервал изменения окраски индикатора, если известна константа его кислотной диссоциации.
На величину интервала перехода и показателя титрования рТ индикатора влияют различные факторы: 1) неодинаковая интенсивность окраски кислой и основной форм индикатора, 2)концентрация индикатора, 3)ионная
сила раствора, 4)концентрация растворенного диоксида углерода, 5)присутствие белковых веществ и коллоидов, 6)температура.
При неодинаковой интенсивности окраски кислой и основной форм индикатора, как отмечалось выше, отношение их концентраций для граничного условия не равно 10 или 0,1, поэтому в уравнении величина второго слагаемого будет отличаться от единицы. Если одна из форм индикатора бесцветна, то для оценки интервала перехода окраски индикатора уравнение непригодно.
На практике интервал перехода окраски индикатора часто определяют не по формуле, а опытным путем. За величину рТ индикатора принимают приблизительно середину найденного интервала перехода. Поэтому pT и pKa индикатора могут не совпадать, хотя различия между ними обычно невелики.
Таблица Величины рКа (при ионной силе около 0), рТ и интервал перехода некоторых кислотно-основных индикаторов.
| Индикатор | pKa | pT | Интервал перехода | Изменение окраски |
| Тимоловый синий | 1,65 | 2,0 | 1,2 - 2,8 | красная - желтая |
| Метиловый желтый | 3,1 | 3,0 | 2,9 – 4,0 | тоже |
| Метиловый оранжевый | 3,5 | 4,0 | 3,2 – 4,4 | » |
| Бромкрезоловый зеленый | 4,9 | 4,5 | 3,8 – 5,4 | желтая - синяя |
| Метиловый красный | 5,0 | 5,5 | 4,2 – 6,2 | красная - желтая |
| Бромкрезоловый пурпурный | 6,4 | 6,0 | 5,2 – 6,8 | желтая -фиолетовая |
| Бромтимоловый синий | 7,3 | 7,0 | 6,0 – 7,6 | желтая - синяя |
| Феноловый красный | 8,0 | 7,5 | 6,8 – 8,4 | желтая - красная |
| Тимоловый синий | 9,2 | 8,5 | 8,0 – 9,6 | тоже |
| Фенолфталеин | 9,5 | 9,0 | 8,2 – 10,0 | бесцветная - красная |
| Тимолфталеин | 9.6 | 10,0 | 9,4 -10,6 | бесцветная - синяя |
| Ализариновый желтый | 10.1 | 11,0 | 9,7 – 10,8 | желтая - фиолетовая |
| Лакмус | 7,0 | 4,5 – 8,3 | красная - жёлтая |
Классификация кислотно-основных индикаторов.
Кислотно-основные индикаторы, как правило, - обратимые индикаторы, способные обратимо изменять окраску в зависимости от рН раствора.
Предложено более 200 органических соединений в качестве кислотно-основных индикаторов Их классифицируют различным образом.
1) Классификация по строению индикаторов. Среди предложенных кислотно-основных индикаторов имеются соединения, относящиеся к различным структурным типам.
а) Индикаторы азосоединений (азоиндикаторы). Это довольно многочисленная группа кислотно-основных индикаторов, являющихся производными пара-аминобензола и пара-диметиламиноазобензола, которые сами по себе практически не растворяются в воде. При введении сульфогрупп или карбоксильных групп в молекулы этих соединений получаются растворимые в воде азокрасители, обычно имеющие (с различными оттенками) красную окраску в кислой среде и желтую — в щелочной.
В структуре молекул этих соединений имеется хромофорная азогруппа.
К индикаторам этой группы, помимо 1)метилового оранжевого относятся 2)ализариновый желтый, 3)метиловый желтый, 4)метиловый красный, тропеолины и др.
б) Трифенилметановые индикаторы. Индикаторы этой группы также
часто применяются в кислотно-основном титровании. Все они формально
могут рассматриваться как производные трифенилметана, имеющие различные заместители в ароматических ядрах. Из индикаторов этой группы распространены фенолфталеины, сульфофталеины, анилинсульфофталеины, бензеины, собственно трифенилметановые красители.
Изменение окраски индикаторов этой группы в водных растворах не очень резкое; они чаще применяются при кислотно-основном титровании в неводных средах.
в) Нитроиндикаторы представляют собой ароматические нитропроизводные, например пара-нитрофенол, который в растворе претерпевает превращения.
Интервал перехода лежит в пределах изменения рН от 5,6 (бесцветный) до 7,6 (желтый).
К этой группе индикаторов относятся также мета- и ортонитрофенолы, динитрофенолы и некоторые другие.
г) Индикаторы других структурных типов - группа включает все остальные индикаторы различного строения, не относящиеся к вышеописанным, например лакмус, оксиновый синий, нейтральный красный, индофенолы, производные фенилгидразина, экстракты растений и др.
Из индикаторов данной группы наиболее распространенным является, по-видимому, лакмус. Обычно он применяется в виде лакмусовой бумаги (бумага, пропитанная лакмусом), которая окрашивается в кислой среде в красный цвет, а в щелочной - в синий.
Лакмус представляет собой органическое вещество синего цвета, которое получают из лишайников в виде синего порошка (или шариков, кубиков). Частично растворим в воде и в этаноле. Главный компонент лакмуса, обладающий индикаторными свойствами, — азолитимин, его содержание в лакмусе составляет 4—5%. Интервал перехода лакмуса как кислотно-основного индикатора лежит в пределах рН от 4,5 до 8,3; при этом окраска изменяется из красной на синюю. Значение рТ ~ 7,0.
2) Классификация по способу применения.
а) Внутренние индикаторы добавляются непосредственно в титрируемый раствор. Подавляющее число кислотно-основных индикаторов – внутренние.
б) Внешние индикаторы находятся вне титруемого раствора. Примером может служить лакмусовая бумага (красная, нейтральная, синяя).
К внешним индикаторам относится универсальная индикаторная бумага, предназначенная для приблизительного определения pH раствора. Индикаторная бумага представляет собой полоски бумаги пропитанной различными индикаторами (ализарин, конго красный, синий и красный лакмус и др.). Сухую полоску индикаторной бумаги смачивают испытуемым раствором и немедленно по окраске бумаги судят о величине раствора. Обычно комплект индикаторной бумаги снабжается цветной шкалой с указанием того, какая окраска бумаги отвечает тому или иному значению рН испытуемого раствора.
3) Классификация по составу индикаторов. Индикаторы бывают индивидуальные и смешанные.
А) Индивидуальные индикаторы состоят из одного соединения.
Б) Смешанные индикаторы представляют собой смесь двух индикаторов и красителя.
Смешанные индикаторы обладают более резким изменением окраски, чем составляющие их индивидуальные индикаторы.
4) Классификация индикаторов по цветности. Индикаторы бывают одноцветные и двухцветные.
Одноцветный индикатор - такой индикатор, который окрашен только по одной стороне своего интервала перехода и бесцветен с другой или же имеет большую или меньшую интенсивность одной и той же окраски на одной из сторон своего интервала перехода.
К одноцветным индикаторам относятся: а) фенолфталеин, который при pH <8 бесцветен, a при рН > 9 окрашен в красный цвет, а также б) паранитрофенол, который бесцветен при рН < 5,6 и имеет желтую окраску при рН > 7,6. Одноцветным является смешанный индикатор из фенолфталеина и тимолфталеина, который бесцветен в кислой среде и имеет фиолетовую окраску в щелочных растворах (табл. 3.2).
Двухцветный индикатор - это индикатор, который имеет две разные окраски – по одной по каждой стороне своего интервала перехода.
Большинство кислотно-основных индикаторов – двухцветные.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 15865; Нарушение авторских прав?; Мы поможем в написании вашей работы!