
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кривые кислотно-основного титрования
|
|
|
|
Кривые кислотно-основного титрования графически отображают зависимость изменения рН титруемого раствора от объема прибавленного титранта или от степени оттитрованности f = V(T)/V, где К(Т) и V- соответственно объем прибавленного титранта в данный момент и в ТЭ.
Чаще всего (хотя не всегда) при построении кривых кислотно-основного титрования вдоль оси абсцисс откладывают объем прибавленного титранта или степень оттитрованности, а вдоль оси ординат — значения рН титруемого раствора. В дальнейшем мы будем рассматривать кривые титрования, построенные в таких координатах.
Анализ кривых титрования позволяет определить интервал ∆рН раствора вблизи ТЭ, т.е. величину скачка на кривой титрования, или сокращенно скачка титрования, и выбрать подходящий индикатор так, чтобы значение рT индикатора укладывалось внутри скачка титрования. Другими словами, анализ кривых титрования позволяет указать оптимальные условия (концентрация реагентов, индикатор) проведения титрования.
Расчет, построение и анализ кривых титрования. Для построения кривой кислотно-основного титрования рассчитывают значения рН титруемого раствора в различные моменты титрования, т.е. в разных точках титрования: 1) для исходного раствора, 2) для растворов до ТЭ, 3) в ТЭ, 4) после ТЭ.
В основе титриметрических расчетов лежит закон эквивалентов. Рассчитанные кривые титрования могут несколько отличаться от реальных экспериментальных кривых титрования, поскольку при расчете значений рН растворов используют не активности, а концентрации.
Различают 4 случая:
Случай 1: Титрование сильной кислоты сильным основанием. При титровании сильной кислоты щелочью до ТЭ значение рН титрируемого раствора определяется концентрацией исходной сильной кислоты, рН < 7. В ТЭ среда нейтральная, рН =7. После ТЭ значение рН титруемого раствора определяется концентрацией избыточного титранта - щелочи, рН > 7.
Рассчитаем значения рН раствора в различные моменты титрования.
Пусть одноосновную кислоту НА титруют сильным основанием МОН:
НА + МОН = МА + Н2О
Х Т
Введем следующие обозначения: с'(Х) - концентрация исходного раствора титруемой кислоты; с(Х) - текущая концентрация кислоты в титруемом растворе; с'(Т) - концентрация прибавляемого раствора титранта; с(Т) - концентрация избыточного титранта в титруемом растворе после ТЭ; V(X) - исходный объем титруемого раствора; V(Т) - объем прибавленного титранта.
Расчет рН титруемого раствора до ТЭ. Значение 1) рН исходного раствора равно рН = -lg c'(X).
2) до ТЭ: рН = -Ig  , рН < 7 (3)
, рН < 7 (3)
3) Расчет рН в точке эквивалентности. При титровании сильной кислоты сильным основанием среда в ТЭ – нейтральная, рН = 7.
4) Расчет рН после точки эквивалентности. Значение рН титруемого раствора после ТЭ определяется концентрацией с(Т) щелочи, прибавленной сверх стехиометрического количества. Т.к. рН + рОН = 14, то
рН = 14 + Ig  , рН > 7 (4)
, рН > 7 (4)
по формулам рассчитывают рН раствора в различные моменты титрования, и по перечисленным данным строят кривую титрования в координатах рН- V(T).
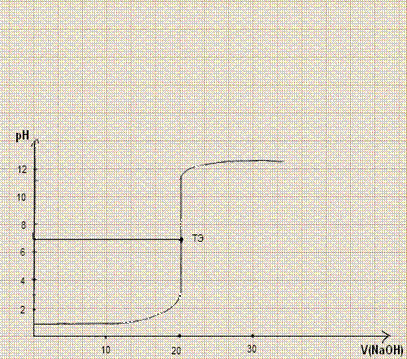
Рассмотрим конкретный пример: 20 мл р-ра НCI с С = 0,1000 моль/л титруют р-ом NaOH той же концентрации. Построить кривую титрования.
Расчёт pH до ТЭ
pH1 = -lg10-1 = 1



В точке эквивалентности pH5 = 7
Расчёт после ТЭ

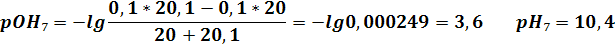
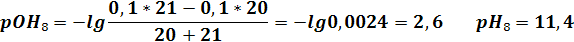


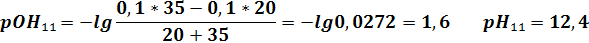
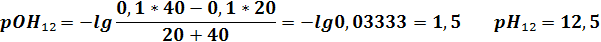
| VNaOH | 19,9 | 19,98 | 20,02 | 20,1 | ||||||||
| pH | 2,6 | 3,6 | 4,3 | 9,7 | 10,4 | 11,4 | 12,1 | 12,3 | 12,4 | 12,5 |
HCl + NaOH  NaCl + H2O
NaCl + H2O
0,1 0,1
моль/л моль/л
Скачок титрования от рН = 3 до рН = 11,3. В ТЭ при рН = 7 – р-р нейтральный. Для определения ККТ можно использовать Ind: метил-оранжевый (рТ), метил-красный (рТ = 5,5), бромтимоловый синий (рТ = 7,0), фенолфталеин (рТ = 9), те Ind, для которых рН лежит в интервале от рН = 3 до рН = 11.
Вывод: чем больше скачок титрования, тем большее число Ind можно использовать для определения ККТ.
Титровать растворы с концентрацией меньше 10-4 моль/л не рекомендуется, т.к. чем меньше концентрация реагентов, тем меньше скачок титрования (значит тем труднее подобрать Ind для определения ККТ).
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 7443; Нарушение авторских прав?; Мы поможем в написании вашей работы!