
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Сущность метода неводного титрования
|
|
|
|
Ограничение возможностей методов титрования в водных растворах.
Вода – наиболее распространенный и доступный растворитель. Рассмотренные в предыдущих главах титриметрические методы количественного химического анализа основаны на использовании воды в качестве растворителя: водный анализируемый раствор титруют водным раствором титранта. Однако титрование а водной среде имеет свои ограничения. В случае кислотно-основного титрования такими ограничениями являются, по крайней мере, следующие.
1) B водных растворах очень слабые кислоты и основания (рК > 7) не титруются. На кривых титрования таких кислот и основания скачок практически отсутствует, поэтому невозможно подобрать соответствующий индикатор для фиксации КТТ.
2) Если в водном растворе присутствует смесь кислот, у которых разница в показателях констант кислотной диссоциации ∆рКа составляет, величину, меньшую четырех единиц (∆рКа < 4) то такие кислоты раздельно не титруются.
3) Сильные кислоты (или сильные основания), совместно присутствующие в водном растворе, раздельно не титруются. Так, например, если в водном растворе одновременно содержатся сильные хлороводородная, азотная и серные кислоты, то все они диссоциируют практически полностью, отщепляя протоны с образованием ионов гидроксония Н3О+. При титровании смеси сильных кислот раствором сильного основания все ионы гидроксония оттитровываются одинаково, независимо от того, при диссоциации какой кислоты они образуются. В результате на кривой титрования смеси сильных кислот сильным основанием наблюдается только один скачок. Поэтому можно определить только их суммарное содержание.
4) Многие вещества обладают незначительной растворимостью в воде (но могут растворяться в каких-то других растворителях). Титрование таких веществ в водных растворах невозможно.
Титрование в неводных средах, неводное титрование, - такое титрование, при котором средой служит неводный растворитель с минимальным содержанием воды.
В качестве неводных растворителей применяют обычно обезвоженные (преимущественно органические) жидкости индивидуальные вещества или их смеси, например: ацетон, диметилформамид, диметилсульфоксид, диоксан, кислоты (уксусная, муравьиная), метилэтилкетон, нитрометан, пиридин, спирты (метанол, изопропанол, третичный бутиловый спирт), этилен диамин и др.
Окончание титрования при использовании неводных растворителей фиксируют либо: 1) визуальным индикаторным методом, либо, что предпочтительнее, потенциометрически, 2) методом потенциометрического титрования.
Метод — фармакопейный, широко используется в количественном,
анализе многих лекарственных препаратов и включен во все известные
фармакопеи.
Применение неводного титрования расширяет возможности титриметрического анализа и позволяет убрать все ограничения водного титрования. Например:
1) Многие органические вещества, не растворимые в воде, хорошо растворяются в различных органических растворителях, что позволяет определять их титриметрическими методами.
2) Силу слабых в водных растворах кислот и оснований можно увеличить подбором растворителя, в котором их титрование становится возможным.
3) Применение растворителей, понижающих силу кислот и оснований, по сравнению с их водными растворами, позволяет раздельно титровать такие кислоты, которые являются сильными в водных растворах, например, смесь хлороводородной HCl и хлорной HClO4 кислот.
Классификация растворителей, используемых в неводном кислотно-основном титровании. По своим кислотно-основным свойствам, т.е. (в рамках протолитической теории кислот и оснований Бренсте-да-Лоури) по способности отдавать или присоединять протоны, растворители разделяют апротонные, протонные (протолические) и амфипротные.
Используют 2 вида классификации: I по кислотно-основным свойствам:
1) Апротонные растворители не проявляют кислотно-основных свойств. Молекулы таких веществ не отдают и не присоединяют протоны. К их числу относятся бензол, толуол, гексан, четыреххлорисый углерод, хлороформ и некоторые другие. Апротонные растворители мало влияют на кислотно-основные свойства растворенных в них веществ.
2) Протонные, или протолитические, рaстворители обладают выраженными кислотно-основными свойствами. Молекулы подобных растворителей способны отдавать или присоединять протоны. При таком определении протонных растворителей к ним могут относиться: 1) как жидкости, молекулы которых сами содержат способные к отщеплению протоны (пример: спирты, амины, карбоновые кислоты, минеральные кислоты), 2) так и жидкости, молекулы которых не содержат протоны, которые могли бы отщепляться при ионизации молекулы растворителя (пример: пиридин).
Так, молекула пиридина C6H5N, являющегося органическим основанием, может присоединять протон, образуя катион пиридония (пиридиния) C6H5NH+:
C6H5N + H+ = C6H5NH+
пиридин катион пиридония
хотя молекула пиридина не имеет собственных протонов, способных к ионизации в значительной степени в обычных условиях, т.е. не может проявлять свойства кислоты (отдавать протоны). Тем не менее, в границах рассматриваемой классификации жидкий пиридин как растворитель относится к протонным растворителям, поскольку может присоединять протоны от растворенных в нем веществ.
3) Амфипротные (амфотерные) – они тоже являются протонными.
Такие растворители, молекулы которых обладают способностью принимать и отдавать протоны, называют амфипротными (амфолитными, амфотерными).
Молекулы таких веществ, как жидкий аммиак или безводная жидкая уксусная кислота, имеют протоны, которые могут отщепляться с образованием соответственно амид-анионов NH2- и ацетат-ионов СН3СОО-:
NH3 = H+ + NH2-
CH3COOH = H+ + CH3COO-
В этом случае аммиак и уксусная кислота выступают в роли кислоты
по Бренстеду – Лоури.
Молекулы тех же веществ способны и присоединять протоны, давая соответственно катионы аммония NH4+ и ацетония CH3COOH2+:
NH3 + H+ = NH4+
CH3COOH + H+ = CH3COOH2+
В этом случае аммиак и уксусная кислота выступают в роли основания по Бренстеду-Лоури.
Амфипротные растворители подвергаются автопротолизу.
В общем случае реакцию автопротолиза можно представить в виде:
SH + SH= SH2+ + S-
катион лиония анион лиата
где SH — условное обозначение молекулы растворителя (сольвента). При этом катионы SH2+ называют катионами лиония (или просто лионием), а анионы S- — анионами лиата (или просто лиатом).
Примерами реакций автопротолиза в чистых жидких растворителях могут служить равновесия амфотерных растворителей:
H2SO4 + H2SO4 = H3SO4+ + HSO4-
H2S + H2S = H3S+ + HS-
CH3COOH + CH3COOH = CH3COOH2+ + CH3COO-
H2O + H2O = H3O+ + OH-
CH3OH + CH3OH = CH3OH2+ + CH3O-
C2H5OH + C2H5OH = C2H5OH2+ + C2H5O-
NH3 + NH3 = NH4+ + NH2-
C6H5NH2 + C6H5NH2 = C6H5NH3+ + C6H5NH-
HCONH2 + HCONH2 = HCONH3+ + HCONH- и тд.
Равновесие автопротолиза — это химическое равновесие, для которого можно выразить концентрационную константу равновесия К в виде:
К= [SH2+][S-]/[SH]2.
Поскольку в чистом жидком растворителе концентрация самого растворителя постоянна, т.е. [SH]2 = const, то
K[SH]2=[SH2+][S-] = const.
Вводя обозначение K[SH]2 = KSH, получаем:
KSH =[SH2+][S-]
Величина КSH называется константа автопротолиза или ионное произведение (иногда ее обозначают символами КS или Кi); она равна произведению равновесных концентраций ионов лиония и лиата в чистом растворителе. Как и всякая константа химического равновесия, константа автопротолиза зависит от природы растворителя и температуры. Очевидно, что для воды константа автопротолиза — это ионное произведение воды Kw = [Н3О+][ОН-].
Как известно, для водных растворов
pH = -lga(H3O+) ≈-lg[H3O+]
и для чистой воды при комнатной температуре рН=7
14 = рН + рОН
рКW/2 = 14/2 = 7
В неводных растворителях, не содержащих воды, ионы гидроксония H3O+ и гидроксид-ионы ОН- отсутствуют, поэтому кислотно–основные свойства неводных растворителей и растворов уже нельзя характеризовать величинами рН или рОН в обычном смысле. Поскольку, однако, ион лиония SH2+ представляет собой протон, сольватированный молекулой данного растворителя (SH • Н+), подобно иону гидроксония Н3О+, представляющему собой протон, гидратированный молекулой воды (Н2О • Н+), то для неводных растворителей можно ввести величину поэтому вводят pSH2+ = -lg[SH2+], вместо рН = - lg[Н3О+] = - lg[Н+]
Иногда ее также условно обозначают символом рН:
рН = pSH2+ = -lg[SH2+].
Величина рОН для неводных растворителей не используют.
Если для водных растворов нейтральной среде при комнатной температуре соответствует значение рН = 7. то для безводной серной кислоты — значение рН = 1,81, для метанола — 8,35, для этанола — 9,55, для жидкого аммиака при -50 °С - величина 16,26 и т.д.
В зависимости от доминирующих свойств молекул протонного растворителя отдавать протоны растворенному веществу, присоединять протоны от растворенного вещества или практически не отдавать и не присоединять протоны, протолитические растворители подразделяют—на протогенные, протофильные и нейтральные.
II вид классификации по доминирующим свойствам растворителя.
1) Протогенные (кислые, кислотные) растворители - такие растворители, у которых доминирует способность отдавать протоны растворенному веществу, т.е. они обладают протоно-донорными (кислотными) свойствами. К растворителям этого типа относятся безводные серная, муравьиная, уксусная, пропионовая кислоты, жидкий фтористый водород H2F2 и некоторые другие. Такие растворители повышают силу растворенных в них оснований и понижают силу растворенных в них кислот.
2) Протофильные (основные) растворители — такие растворители, у которых доминирует способность принимать протоны — присоединять протоны от растворенных в них веществ, т.е. они обладают протоно-акцепторными (основными) свойствами. К таким растворам относятся жидкие аммиак, амины (например, н-бутиламин), формамид, пиридин, этилендиамин, диметилформамид и некоторые другие. Растворители этого типа понижают силу растворенных в них оснований и повышают силу растворенных в них кислот.
Так, уксусная кислота в водном растворе — слабая кислота, тогда как в жидком аммиаке она становится сильной.
3) Нейтральные растворители — такие растворители, которые обладают примерно одинаковой способностью принимать протоны от растворенных в них веществ и отдавать протоны растворенным в них веществам. К таким растворителям относятся метанол, этанол, изопропанол, трет-бутанол, ацетон, метилэтилкетон, диоксан, нитрометант диметил-сульфоксид, ацетонитрил и некоторые другие.
Нивелирующее и дифференцирующее действие растворителей.
Из вышеизложенного следует, что растворители могут влиять на кислотно-основные свойства растворенных в них веществ. Это выражается в нивелирующем и дифференцирующим действием растворителей.
1) Нивелирующее действие проявляется в выравнивании силы растворенных в нем протолитов. Нивелирующее действие оказывают протофильные растворители на силу растворенных в них кислот. Так, хлорная и хлороводородная кислоты в водных растворах — сильные, а уксусная кислота - слабая. В растворе протофильного растворителя — жидкого аммиака — все эти три кислоты становятся сильными, включая и уксусную кислоту.
Аналогично в растворах этилендиамина и уксусная, и хлорная кислоты являются сильными.
Протогенные растворители могут оказывать нивелирующее действие. на растворенные в них основания. Например, в водных растворах гидроксид натрия NaOH — сильное основание (щелочь), а аммиак — слабое. В растворе же протогенного растворителя — безводной серной кислоты — оба основания становятся сильными.
2) Дифференцирующее действие растворителя проявляется в увеличении различий в силе растворенных в нем протолитов. Такие растворители используют для раздельного титрования смесей кислот или оснований, поскольку различия в показателях констант кислотности или основности веществ, растворенных в подобных растворителях, возрастают по сравнению с водными растворами, вследствие чего становится возможным их раздельное титрование.
Так, в водном растворе хлорная и хлороводородная кислоты — сильные. В растворе же безводной уксусной кислоты они становятся слабыми с различной силой: для HClO4 Ka ≈ 10-4; для HCl Ka ≈ 10-7.
В безводной уксусной кислоте сила неорганических кислот понижается в следующей последовательности: НСlO4>HBr>H2SO4>HCl>HNO3. Наиболее сильной кислотой является хлорная кислота, наиболее слабой — азотная. Поэтому при проведении титрования оснований в среде безводной уксусной кислоты в качестве титранта предпочитают выбирать раствор хлорной кислоты как наиболее сильной.
Влияние диэлектрической проницаемости растворителя. Диэлектрическая проницаемость ε характеризует способность растворителя уменьшать силу электростатического взаимодействия заряженных частиц по сравнению с вакуумом. Чем больше величина диэлектрической проницаемости (диэлектрической постоянной) растворителя, тем меньше сила электростатического притяжения между катионом и анионом растворенного вещества, тем более глубоко должна протекать его электролитическая диссоциация.
Так, для двух растворителей примерно одинаковой основности — воды и этанола — диэлектрическая проницаемость различна: при комнатной температуре для воды она равна 78,25. а для этанола — 24,25. Следовательно, в воде диссоциация электролита должна протекать более глубоко, чем в этаноле.
Действует общее правило: для повышения силы протолита следует выбирать растворитель с большей величиной диэлектрической проницаемости.
В растворах растворителей с малой диэлектрической проницаемостью катион и анион растворенного вещества, возникающие в начальном акте электролитической диссоциации (ступень ионизации), все еще удерживаются силами электростатического притяжения друг около друга, образуя ионную пару. В дальнейшем эта ионная пара распадается на катион и анион вследствие взаимодействий с окружающими частицами (ступень полной диссоциации). Увеличение диэлектрической проницаемости растворителя способствует понижению устойчивости и распаду ионной пары, что приводит к росту силы растворенного электролита.
Полнота протекания реакций в неводных растворителях.
Она зависит от величины К-const равновесия той реакции, которая протекает в неводном растворе. Чем К больше, тем полнее идет реакция.
Здесь возможно 2 случая:
1) Титрование слабого основания В сильной кислотой.
Пример: В – основание, его титруют сильной кислотой НСlO4 в растворителе – безводной CH3COOH. Если Кв – const основности основания В, КSH – const автопролиза растворителя, то константа равновесия реакции титрования слабого основания В хлорной кислотой в среде безводной уксусной кислоты равна:
К = 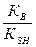
Из соотношения следует, что полнота протекания реакции, характеризуемая величиной константы равновесия К, тем больше, чем выше константа основности Кв титруемого основания В и чем меньше константа автопролиза KSH растворителя.
2) Титрование слабой кислоты НВ сильным основанием.
Пример: слабую кислоту НВ титруют сильным основанием C2H5OH (это SH).
Тогда для константы равновесия К получаем:
К =  , где
, где 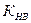 - константа кислотности
- константа кислотности
где КSH = [С2Н5ОН2+][С2Н5О-] —константа автопротолиза растворителя (этанола).
Из уравнения следует, что полнота протекания реакции титрования слабой кислоты НВ сильным основанием, характеризуемая величиной константы равновесия К, тем больше, чем выше константа кислотной диссоциации слабой кислоты НВ и чем меньше константа автопротолиза КSH растворителя.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 16679; Нарушение авторских прав?; Мы поможем в написании вашей работы!