
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Класифікація методів титриметричного аналізу
|
|
|
|
Методи визначення ТЕ.
Загальна характеристика методу та основні операції титриметричного аналізу.
План
Лекція №10
Тема: Титриметричний аналіз.
1. Загальна характеристика методу та основні операції титриметричного аналізу.
2. Класифікація методів титриметричного аналізу.
3. Класифікація розчинів у титриметричному аналізі.
4. Способи вираження вмісту розчиненої речовини у розчині.
Титриметичний аналіз ґрунтується на точному вимірюванні об’єму розчину реагенту точно відомої концентрації, який витрачається в реакції з еквівалентною кількістю речовини, яку визначають.
Основні операції титриметричного аналізу:
а) приготування розчинів стандартної і аналізованої речовин;
б) титрування;
в) обчислення.
Титрування – це процес визначення концентрації речовини А поступовим додаванням невеликих кількостей речовини Б, при якому забезпечується виявлення точки еквівалентності (ТЕ) -точки в якій вся речовина А прореагувала. Розчин, що містить активний реагент називається титрантом (Б).
Титрант заливають у бюретку, а розчин, який титрують (А) – титрований розчин -у конічну колбу. Наприклад при титруванні розчину NaOH, який необхідно аналізувати, титрантом HCl відбувається реакція:
NaOH+HCl=NaCl+H2O,
В точці еквівалентності
ОН-+Н+=Н2О,
n(OH-)=n(Н+),
або n(NaOH)= n(HСl).
Терміни «стехіометрична» точка, кінцева точка титрування, точка еквівалентності – це синоніми.
За концентрацією і об’ємом HСl, використовуючи закон еквівалентів визначають вміст NaOH:
V(NaOH)·C(NaOH)=V(HСl)·C(HСl).
- За допомогою спеціальних індикаторів;
- за забарвленням реагуючих речовин;
- за допомогою спеціальних приборів та пристроїв.
Вимоги до реакції в титриметричному аналізі:
- швидкість і необоротність;
- стехіометричність;
- взаємодія речовин при звичайних умовах (тиск і температура);
- наявність способу виявлення ТЕ.
Методи титриметичного аналізу класифікують:
І. За прийомами виконання операцій:
а) Пряме титрування – розчин, який містить визначувану речовину (Х) безпосередньо титрують розчином з точно відомою концентрацією речовини А
Х+А→
Розрахунок проводять за рівнянням матеріального балансу за кількістю еквівалентів:
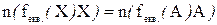
Прикладом може бути визначення вмісту лугу в розчині відповідно рівнянню:
2NaOH+H2SO4→2H2O+NaSO4
Рівняння матеріального балансу:
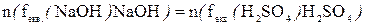 ,
,

б) Непряме або обернене титрування – ґрунтується на титруванні залишку, тобто до розчину, який містить визначувану речовину Х додають стандартний розчин А у надлишку. Залишок стандартного розчину А, який не прореагував відтитровують стандартним розчином В.
Х+Анадл→...
Азалишок+В →...
Розрахунок проводять за рівнянням матеріального балансу:

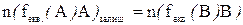 ,
,
тоді,  .
.
в) Титрування замісника або реверсивне титрування використовують якщо основна реакція не задовольняє вимогам до реакцій титриметричного аналізу, (наприклад неможливо зафіксувати ТЕ або основна речовина не взаємодіє з титрантом). Визначувану речовину заміщують еквівалентною кількістю іншої речовини, яку потім відтитровують. Наприклад в йодометрії при визначенні окисників до розчину окисника додають допоміжний розчин (КІ) концентрація і об’єм якого приблизний, але взятий у надлишку
2Fe3++2I¯→2Fe2++I2
В даній реакції не можливо зафіксувати ТЕ і тому визначувану речовину Fe3+ можна замістити йодом, який потім відтитровують тіосульфатом натрію.
I2+2Na2S2O3↔2NaI+Na2S4O6,
 .
.
ІІ. За типом аналітичної реакції:
а) Кислотно-основне титрування або протолітометрія.
Методи кислотно-основного титрування ґрунтуються на протолітометричній реакції:
Н3О++ОН-=2Н2О або Н++ОН-=Н2О
та використовуються для кількісного визначення кислот (алкаліметрія), основ (ацидиметрія), солей а також їх сумішей.
б) Окисно-відновне титрування або редоксометрія.
Методи редоксометрії ґрунтуються на хімічних реакціях, які відбуваються зі зміною ступеня окислення реагуючих речовин.
в) Оаджувальне титрування.
В основі методів осадження лежать реакції, в результаті яких відбувається утворення малорозчинних сполук, тобто реакції осадження.
г) Комплексонометричне титрування.
Реакції утворення комплексних і малодисоційованих сполук є основою даного методу.
ІІІ. За технікою виконання титрування:
а) Спосіб окремих наважок – наважку визначуваної речовини розчиняють у певному об’ємі і титрують весь розчин.
б) Спосіб піпеткування – наважку речовини, яку визначають, розчиняють в мірній колбі, потім відбирають піпеткою аліквоту (точно фіксований об’єм) і відтитровують визначувану речовину. При розрахунках маси визначуваної речовини враховують, що титрували тільки певну частину розчину тому вводять множник Vм.к /Vал..
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 2623; Нарушение авторских прав?; Мы поможем в написании вашей работы!