
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Способи вираження вмісту розчиненої речовини у розчині
|
|
|
|
Класифікація розчинів у титриметричному аналізі.
Розчини титриметичного аналізу класифікують:
І. За способом приготування:
а) Первинні стандартні розчини (або розчини з приготованим титром), їх готують розчиненням точної наважки первинної стандартної речовини (вихідної речовини) і розведенням одержаного розчину до певного об'єму, тобто одержують розчин з точно відомою концентрацією реагенту. Для приготування первинних стандартних розчинів використовують речовини: Na2B4O7·10H2O; Na2CO3; NaCl; KCl; K2Cr2O7; Na2C2O4. Для приготування таких розчинів також використовують «стандарт-титри» або фіксанали – це точна порція розчину або твердої речовини в скляній ампулі, яка містить 0,1 моль еквівалента речовини та розрахована для приготування розчину об'ємом 1 дм3 (1л) з молярною концентрацією еквівалента 0,1000моль/дм3.
Вимоги до первинних стандартних розчинів:
- кваліфікація «х.ч.»;
- стійкі на повітрі і розчині;
- хімічна формула відповідає хімічному складу речовини;
- велика молярна маса еквівалента;
- розчиняються у воді;
- форма речовини зручна для взяття наважки.
б) Вторинні стандартні розчини або стандартизовані (розчини з встановленим титром) – це розчини, концентрацію яких встановлюють за первинними стандартними розчинами. Для приготування вторинних стандартних розчинів використовують речовини: HCl; Н2SO4; NaOH; КОН; Ва(ОН)2; NH3·H2O тощо.
Стандартизація – це процес встановлення точної концентрації речовини у розчині, який здійснюється титруванням.
ІІ. За призначенням розчини діляться на:
а) Установочні розчини – це розчини приготовлені з первинних стандартних речовин і використовуються для стандартизації робочих розчинів, тобто для встановлення концентрації або титру робочого розчину.
б) Робочі розчини або титранти – це розчини з точно відомою концентрацією, тобто стандартизовані, які використовуються для визначення концентрації невідомої речовини у розчині.
При розрахунках в кількісному аналізі використовують наступні терміни та поняття, які прийняті в Міжнародній системі одиниць (СІ).
Моль (n) – кількість речовини, яка містить стільки визначених умовних одиниць, скільки атомів міститься в 12 г вуглецю 12С, тобто 6,02045·1023. Умовні одиниці – молекули, іони, електрони, радикали, а також частки молекул або частки іонів.
Молярна маса (М) – це маса 1 моль речовини. Основною одиницею молярної маси є кг/моль, на практиці використовується розмірність г/моль.
Хімічний еквівалент – це реальна або умовна частина речовини, яка взаємодіє з 1 моль атомів водню або заміщує його в реакції, а також може прийняти (віддати) 1 моль електронів в окисно-відновних реакціях.
Фактор еквівалентності (fекв) . – це число, яке показує яка частка реальної частинки речовини еквівалентна одному іону водню в конкретній кислотно-основній реакції або одному електрону в конкретній окисно-відновній реакції. Фактор еквівалентності може дорівнювати одиниці або бути менше одиниці та розраховується за стехіометричним рівнянням реакції. Наприклад в реакції
2HCl+Na2CO3=NaCl+H2CO3
фактор еквівалентності fекв(Na2CO3)=1/2.
А в реакції
HCl+Na2CO3=NaCl+NaHCO3
фактор еквівалентності fекв(Na2CO3)=1.
Для калій манганат(VII) в кислому середовищі фактор еквівалентності fекв(KMnO4)=1/5, а в нейтральному та лужному середовищі fекв(KMnO4)=1/3 відповідно іонно-електронних рівнянь:
MnO4-+8H++5e=Mn2++4H2O
MnO4-+2H2O+3e=MnO2+4OH-
Молярна маса речовини еквівалента (М(fекв(Х)Х) – це маса одного моль еквівалента цієї речовини, яка пов’язана з молярною масою співвідношенням:

Молярна концентрація речовини Х або молярність C(X), -це кількість моль розчиненої речовини в 1 літрі розчину.
 , моль/дм3 або моль/л.
, моль/дм3 або моль/л.
де m(X) – маса розчиненої речовини Х, г;
М(X) – молярна маса речовини Х, г/моль;
V – об’єм розчину, л;
n(X) – кількість моль розчиненої речовини Х.
Молярна концентрація речовини еквівалента (нормальна концентрація або нормальність ) C( fекв. (X)Х) - показує, скільки речовини еквівалента міститься в 1 літрі розчину. Розчин, в 1 л якого розчинений 1 еквівалент речовини, називається однонормальним розчином.
 , моль/дм3 або моль/л
, моль/дм3 або моль/л
де М(fекв(Х)Х) – молярна маса еквівалента речовини Х.
Титр розчину Т(Х) – цекількість грамів речовини, яка міститься в 1 см3 або 1 мл розчину.
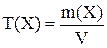 , г/мл або г/см3
, г/мл або г/см3
Для серійних визначень зручно використовувати в розрахунках таке поняття як титр розчину за визначуваною речовиною.
Титр розчину за визначуваною речовиною Т(Х/У) – це маса визначуваної речовини, яка еквівалентна 1 мл стандартного розчину. Наприклад, Т(HCl/NaOH) = 0,01 г/мл означає, що 0,01 г NaOH еквівалентний 1 мл стандартного розчину HCl.
Масова частка речовини в розчині, W(%) - концентрація, яка визначається кількістю грамів речовини у 100 г розчину.

де m(Х) - маса розчиненої речовини; m - загальна маса розчину, яка складається з маси розчиненої речовини та маси розчинника:
m = (m(Х)+ m(р-ну)) або m=ρ(р-ну)·V.
В основі всіх обчислень у титриметричних методах аналізу лежить закон еквівалентів - речовини реагують у співвідношеннях, пропорційних їхнім хімічним еквівалентам. Згідно з цим законом в ТЕ:

тобто
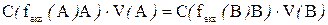
В титриметричних методах аналізу концентрацію розчинів обчислюють до четвертої значущої цифри після коми. Нулі після коми не враховуються, а лише показують на якому місці стоїть перша значуща цифра.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 2006; Нарушение авторских прав?; Мы поможем в написании вашей работы!