
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
На каждом энергетическом уровне может находиться не более двух электронов, причем спины электронов, находящихся на одном уровне, должны иметь противоположные направления
|
|
|
|
Образование энергетических зон.
Точное решение уравнения Шредингера для системы из огромного количества частиц в кристалле невозможно. Эта задача решается приближенно: задача многих частиц сводится к задаче об одном электроне, движущемся в заданном внешнем поле. Этот путь приводит к зонной теории твердого тела.
Энергия электронов в отдельно взятом атоме квантуется, то есть может принимать только дискретные (разделенные конечными промежутками) значения, называемые уровнями энергии.
Пусть мы имеем N изолированных одинаковых атомов. Каждый электрон любого атома может иметь одно из разрешенных значений энергии, то есть занимает один из разрешенных энергетических уровней. В невозбужденном состоянии атома суммарная энергия электронов имеет наименьшее из возможных значений энергии, поэтому, как кажется на первый взгляд, все электроны должны находиться на самом низком уровне. НО электроны подчиняются принципу Паули, применяя который для заполнения электронами энергетических уровней получим:
Поэтому на основном уровне атома может находиться только два електрона, а остальные заполняют болем высокие уровни.
На рис. 27.3 показано распределение електронов по уровням в основном состоянии атома, имеющего 5 электронов. Схема уровней зображена условно, без применения масштаба. Электроны обозначеня кружками со стрелкой. Разные направления стрелок соответствуют противоположным направлениям спинов.

Рис. 27.3
Пока атомы изолированы, они имеют полностью совпадающие схеиы энергетических уровней. Заполнение уровней электронами в каждом атоме происходит независимо от заполнения аналогичных уровней в других атомах. По мере приближения атомов между ними возникает взаимодействие, которое, усиливаясь, приводит к изменению положения уровней. Вместо одного однакового для всех N атомов уровней возникают N очень близких, не совпадающих уровней. Таким образом, каждый уровень изолированного атома расщепляется в кристалле на N густо расположенных уровней, образующих полосу или зону
Величина расщепления для разных уровней не одинакова. Уровни, заполненные в атоме внутренними электронами, возбуждаются меньше, чем уровни, заполненные внешними электронами.
На рис. 27.4 показано расщепление разных уровней как функция расстояния r между атомами. Отмеченные на рисунке значения r 1 и r 2 соответствуют расстояниям между атомами для двух разных кристалов. Из схемы видно, что возникающее в кристалле расщепление уровней, занятых внутренними электронами, очень мало. Заметно расщепляются только уровни, занятые валентными электронами. Такому же расщеплению подвергаются и более высокие уровни, не занятые электронами в основном состоянии атома
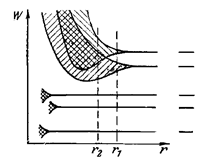
Рис. 27.4
При достаточно малых расстояниях между атомами может происходить перекрытие зон, соответствующим двум соседним уровням атома (см. пунктирную прямую, отвечающаю расстоянию r 2 между атомами). Число уровней в такой слившейся зоне равно сумме количества уровней, на которые расщепляются оба уровня.
Взаимодействующие атомы являються единой квантовой системой, в пределах которой действует принцип Паули. То есть 2 N электронов, заполняющих определенный уровень в изолированных атомах, в кристалле разместятся попарно на N уровнях соответствующей полосы.
Нижние, образованные слабо расщепленными уровными зоны, заполняются электронами, каждый из которых и в кристалле не теряет прочной святи со своим атомом. Эти зоны и электроны, которые их заполняют, дальше не будут нас интересовать.
Разрешенные значения энергии валентных электронов в кристалле объединяются в зоны, разделенные промежутками, в которых разрешенных значений энергии нет. Эти промежутки называются запрещенными зонами. Ширина разрешенных и запрещенных зон не зависит от размеров кристалла. Таким образом, чем больше атомов образует кристалл, тем теснее располагаются урони в зоне. Ширина разрешенных зон порядка нескольких электронвольт. При абсолютном нуле энергия кристалла должны быть минимальной. Поэтому валентные электроны заполнят попарно нижние уровни разрешенной зоны, которая образовалась из уровня, на котором находились валентне электроны в основном состоянии атома (будем называть ее валентной зоной). Более высокие разрешенные зоны будут свободны от электронов.
Образование зонного энергетического спектра - квантово-механический эффект и следствие соотношения неопределенностей: 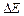 ~
~ 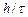 (для валентного электрона в атоме кристалла
(для валентного электрона в атоме кристалла 
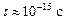 (для изолированного атома
(для изолированного атома 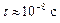 )). Поэтому в кристалле
)). Поэтому в кристалле 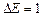 ÷
÷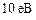 , то есть энергетические уровни валентных электронов расширяются в зоны. Заштрихованные зоны – разрешенные энергетические зоны. У них столько дискретных уровеней, сколько атомов содержит кристалл. Расстояние между уровнями ~
, то есть энергетические уровни валентных электронов расширяются в зоны. Заштрихованные зоны – разрешенные энергетические зоны. У них столько дискретных уровеней, сколько атомов содержит кристалл. Расстояние между уровнями ~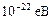 ; оно ничтожно мало, но факт дискретности важен для распредедления электронов по сосояниям. Разрешенные зоны разделеы запрещенными энергетическими зонами ( в них электроны находиться не могут).
; оно ничтожно мало, но факт дискретности важен для распредедления электронов по сосояниям. Разрешенные зоны разделеы запрещенными энергетическими зонами ( в них электроны находиться не могут).
В зависимости от степени заполнения валентной зоны электронами возможны три случая, изображенные на рис. 27.5.
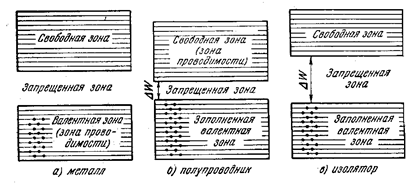
Рис. 27.5
В случае а) электроны заполняют валентную зону не полностью. Поэтому достоточно передать електронам, находящимся на верхних уровнях, сов сем небольшую энергию (~10-23–10-22 эВ) для того, чтобы перевести их на более высокие уровни. Энергия теплового движения (kT) при 1°К составляет величину порядка 10-4 эВ (при комнатной температуре ~1/40 эВ). То есть при температурах, отличных от 0 °К, часть электронов переводится на более высокие урони вследствие их теплового движения. Дополнительная энергия, обусловленная действием на электрон электрического поля, также оказывается достаточной для переведения электрона на болем высокие уровни. Поэтому электроны могут ускоряться электрическим полем и приобретать дополнительную скорость в направлении, противоположном направлению поля. Таким образом, кристалл с подобной схемой заполнения энергетических уровней представляет собой металл.
Частичное заполнение валентной зоны (в случае метала ее также называют зоной проводимости) может происходить, если на последнем занятом уровне в атоме находится только один электрон; или имеет место перекрытие зон (см. рис. 27.4, расстояние r 2). В первом случае число уровней в зоне проводимости будет больше N, так что даже тогда, когда количество электронов проводимости будет равно 2 N, они не смогу занять все уровни зоны.
В случаях б) и в) уровни валентной зоны полностью заняты электронами – зона заполнена. Для увеличения энергии электрона необходимо придать ему энергию, не меньшую, чем ширина запрещенной зоны  . Электрическое поле (при напряженности, при которой не происходит пробой кристала) не в состоянии придать електрону такую энергию. В этом случае электрические свойства кристала определяются шириной запрещенной
. Электрическое поле (при напряженности, при которой не происходит пробой кристала) не в состоянии придать електрону такую энергию. В этом случае электрические свойства кристала определяются шириной запрещенной  . Если ширина запрещенной зоны
. Если ширина запрещенной зоны  небольшая (порядка нескольких десятых эВ), энергии теплового движения оказывается достоточно для того, чтобы перевести часть электронов в верхнюю свободную зону. Эти электроны будут находиться в условиях, аналогичных тем, в которых находяться валентные электроны в металле. Свободная зона для них окажется зоной проводимости. Одновременно станет возможным переход электронов валентной зоны на ее верхние (освободившиеся) уровни. Такое вещество называется электронным полупроводником.
небольшая (порядка нескольких десятых эВ), энергии теплового движения оказывается достоточно для того, чтобы перевести часть электронов в верхнюю свободную зону. Эти электроны будут находиться в условиях, аналогичных тем, в которых находяться валентные электроны в металле. Свободная зона для них окажется зоной проводимости. Одновременно станет возможным переход электронов валентной зоны на ее верхние (освободившиеся) уровни. Такое вещество называется электронным полупроводником.
Если ширина запрещенной зоны  велика (порядка нескольких эВ), тепловое движение не может «забросить» в свободную зону значительное число электронов. В этом случае кристалл является изолятором (диэлектриком).
велика (порядка нескольких эВ), тепловое движение не может «забросить» в свободную зону значительное число электронов. В этом случае кристалл является изолятором (диэлектриком).
Таким образом, квантовая теория объясняет с единой точки зрения существование хороших проводников (металлов), полупроводников и диэлектриков.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1278; Нарушение авторских прав?; Мы поможем в написании вашей работы!