
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Чинники, що впливають на ступінь дисоціації a
|
|
|
|
СТУПІНЬ ДИСОЦІАЦІЇ
Різні речовини дисоціюють неоднаково, але і одна і та сама сполука може піддаватися дисоціації по-різному залежно від умов. Для оцінювання та порівняння міри розкладу речовин на йони користуються величиною ступеня дисоціації.
Ступінь дисоціації a – це відношення концентрації електроліту, що розпався на йони, до його загальної концентрації у розчині:
α = Сдис/Сзаг, (6.1)
де Сдис і Сзаг – відповідно молярна концентрація продисоційованого електроліту і його загальна концентрація, моль/л. Ступінь дисоціації виражається у частках одиниці або у відсотках. Зважаючи на те, що молярна концентрація визначається відношенням кількості речовини ν до об’єму розчину (С=ν/V), то за умов постійного об’єму рівняння (6.1) набуває вигляду:
α = νдис/νзаг. (6.2)
Оскільки здатність речовин до дисоціації залежить від багатьох умов, то і ступінь дисоціації є функцією багатьох перемінних, тому на величину a впливають різні чинники.
1. Природа речовин. Залежно від здатності електроліту до дисоціації і, як наслідок, від величини ступеню дисоціації в розведених розчинах, всі електроліти поділяють на окремі групи: сильні, середньої сили і слабкі (рис. 6.5).

Рисунок 6.5 – Сильні та слабкі електроліти
- Сильні електроліти – це ті, для яких ступінь дисоціації у розведених розчинах має достатньо високі значення (a>0,3 або a>30%), що пояснюється майже повною дисоціацією. З цієї причини в рівняннях реакції дисоціації сильних електролітів замість знака оборотності (Û) ставлять стрілку (à), наприклад: HIàН++І–.
До сильних електролітів належать: більшість солей; сильні кислоти (H2SO4, HClО4, HNO3, HMnО4, HCl, HBr тощо); гідроксиди лужних (LiОН, NaОН, KОН, RbОН, CsОН) і лужноземельних металів (Ca(ОН)2, Sr(ОН)2, Ba(ОН)2); деякі комплексні основи, наприклад, [Cu(NH3)4](OH)2. Крім того, сильними електролітами є також розчини над осадами малорозчинних солей з йонною кристалічною граткою. Незважаючи на погану розчинність таких солей, їх кристалічні гратки під дією диполей води піддаються частковому руйнуванню, внаслідок чого у розчині з'являється невелика кількість йонів, які зумовлюють електричну провідність розчинів і, отже, належність цих солей до групи сильних електролітів. Однак при оцінюванні сили конкретного електроліту завжди слід пам'ятати, що його здатність розпадатися на йони реалізується виключно в розчинах чи розплавах, а у твердому стані електрична провідність відсутня (рис.8.5г) і процес дисоціації не відбувається.
- Електроліти середньої сили, для яких у розведених розчинах величина ступеня дисоціації коливається у межах 0,02<a<0,3 (або 2%<a<30%).
Представниками цієї групи електролітів є: сульфітна H2SO3, ортофосфатна H3PO4, арсенатна H3AsO4, мурашина HCOOH кислоти, деякі солі та основи, наприклад, гідроксид Ca(ОН)2, який в дуже розведених розчинах поводить себе як сильний електроліт, а при збільшенні концентрації – як електроліт середньої сили.
- Слабкі електроліти, які навіть у розведених розчинах дисоціюють частково і мають невисокі значення ступеня дисоціації (a<0,02 або a<2%).
До них належать більшість органічних кислот і основ, слабкі неорганічні кислоти (Н2СО3, H2S, H2SiO3, H3AsO3, HCN, HF, HClO); основа NH3×H2O (або NH4ОН); деякі солі, особливо галогеніди, наприклад, Hg2Cl2, HgCl2, а також значна кількість комплексних йонів ([Fe(CN)6]4–, [Fe(CN)6]3–, [HgI4]2– та інші).
Іноді поділення електролітів залежно від їх здатності до дисоціації (у розчинах концентрації 0,01–0,1н) поділяють тільки на дві групи: сильні і слабкі.
2. Будова молекул речовин. Вплив молекулярної структури на силу електроліта наочно видно на прикладі однотипних молекул кислот HF, HCl, HBr, HI. За умов однакових концентрацій і температур a зростає майже вдвічі при збільшенні довжини і зниженні енергії зв¢язку, тобто при переході від HF до HI.
Для молекул більш складної будови, здатних дисоціювати на декілька йонів, процес протікає ступінчасто, тому ступенів дисоціації може бути декілька. Наприклад, для сульфітної кислоти
H2SO3 Û H+ + HSO3– a1,
HSO3– Û Н+ + SO32– a2,
причому a1 >> a2, тому що відірвати йон Н+ від нейтральної молекули H2SO3 набагато легше, ніж від негативно зарядженого гідросульфіт-аніона HSO3–. Однак поведінка будь-якої кислоти характеризується концентрацією йонів Н+, тому якщо віднести загальну кількість йонів Н+ до кількості молекул Н2SO3 (яка була до початку дисоціації кислоти), можна одержати середнє значення a.
3. Природа розчинника: чим вища його діелектрична стала e, тим більше значення a. Необхідно зауважити, що природа розчинника впливає і на утворення сольватів йонів: більш полярні молекули розчинника легше утворюють сольвати. Деякі йони навіть спроможні утворювати як би постійні сполуки з розчинником. Так, йон гідрогену у воді ізольовано існувати не може і приєднується до молекули води, перетворюючись на йон гідроксонію (рис. 6.6):
Н+ + Н2О à H3O+.
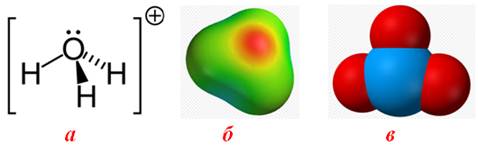
Рисунок 6.6 – Йон гідроксонію H3O+: а) просторова формула, в якій пунктиром показаний донорно-акцепторний зв'язок між йоном Н+ і атомом оксигену молекули Н2О; б) модель, що зображує локалізацію підвищеної електронної густини (у центрі йона H3O+) і дефіциту негативного заряду (на периферії); в) кулькова модель
Але у рівняннях реакції для спрощення записують звичайно тільки формулу Н+, маючи на увазі йон гідроксонію Н3О+.
4. Температура. Ця залежність завжди однозначна: згідно з принципом Ле-Шательє ступінь дисоціації підвищується при нагріванні, оскільки розпад молекул на йони відбувається з поглинанням енергії.
5. Концентрації розчину: у міру розведення розчину ступінь дисоціації зростає. Більш докладніше цю залежність ми розглянемо пізніше.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 5564; Нарушение авторских прав?; Мы поможем в написании вашей работы!