
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон розведення Оствальда
|
|
|
|
Зв¢язок між ступенем дисоціації, концентрацією розчину і константою електролітичної дисоціації встановлює закон розведення Оствальда.
Для його виведення запишемо рівняння електролітичної дисоціації слабкого бінарного електроліту KtAn, у якому символом Kt позначений катіон, а An – аніон:
KtAn Û Kt+ + An–.
Позначимо вихідну молярну концентрацію електроліту через С (моль/л), тоді концентрація тієї частини електроліту, яка піддалася дисоціації, з урахуванням ступеня дисоціації дорівнює aC. Як видно з рівняння реакції, утворюються однакові кількості йонів обох знаків, причому, їх концентрації дорівнюють концентрації продисоційованої частини електроліту:
[Kt+] = [An–] = aC,
а концентрація недисоційованих молекул:
[KtAn] = C – aC = C(1 – a).
Підставляючи значення концентрацій у вираз константи дисоціації, одержимо:
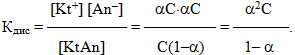 (6.3)
(6.3)
Рівнянням (6.3) математично виражений закон розведення Оствальда.
У тому випадку, коли електроліт дуже слабкий, ступінь дисоціації має невелике значення (a––>0), яким можна знехтувати, тоді знаменник у рівнянні (6.3) прирівнюється до одиниці (1– a)~1, а закон розведення набирає вигляду:
К = a2 C, (6.4)
звідки ступінь дисоціації
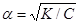 . (6.5)
. (6.5)
Рівняння (6.5) дає можливість сформулювати закон розведення Оствальда:
у міру розведення розчину (тобто зменшення концентрації електроліту) ступінь його електролітичної дисоціації підвищується.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 8381; Нарушение авторских прав?; Мы поможем в написании вашей работы!