
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Добуток розчинності
|
|
|
|
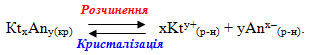
Речовини з обмеженою розчинністю схильні до утворення систем, в яких осад малорозчинної сполуки перебуває у стані рівноваги з її насиченим розчином. Завдяки динамічному характеру рівноваги швидкість розчинення осаду дорівнює швидкості зворотного процесу – кристалізації осаду з насиченого розчину. Наприклад, якщо помістити у воду осад малорозчинного електроліту КtxAny(кр), відбувається його часткове розчинення і у розчин переходить невелика кількість катіонів (Kty+(р-н)) і аніонів (Anx–(р-н)). Після досягнення насичення розчину, починається зворотний перехід йонів з насиченого розчину в осад. У якийсь момент встановлюється динамічна рівновага між обома процесами:
Для загального випадку константа рівноваги має вигляд:

Однак концентрація твердої речовини вважається постійною ([KtxAny]кр=const), тому вона вводиться у константу:
[Kty+]x × [Anx–]y = К × [KtxAny].
Добуток К×[Ktх×Anу] називається добутком розчинності і позначається ДР:
ДРKtxAny = [Kty+]x × [Anx–]y.
Добуток розчинності – це стала за даної температури величина, що кількісно характеризує здатність малорозчинних електролітів до розчинення і визначається добутком концентрацій йонів, піднесених до відповідних степенів.
Значення добутків розчинності для різних сполук наводяться у спеціальних довідниках чи обчислюються за розчинністю речовин. І навпаки, виходячи із величини ДР, можна розрахувати розчинність будь-якої малорозчинної солі.
Чим менша величина добутку розчинності ДР солі, тим гірше ця сіль розчиняється у воді.
Оскільки ДР солі при певній температурі є сталою величиною, то підвищення концентрації одного із йонів, що міститься у її розчині, призводить до зменшення концентрації іншого йона.
Наприклад, якщо до насиченого розчину малорозчинної солі CaSO4 долити невелику кількість сильного електроліту, який має спільний йон з CaSO4 (наприклад, Ca Cl2 чи Na2 SO4) і повністю дисоціює на йони
CaCl2 à Ca2+ + 2Cl–,
Na2SO4 à 2Na+ + SO42–,
це викличе додаткову кристалізацію CaSO4, тому що згідно з принципом Ле-Шательє при збільшенні концентрації йонів Ca2+ або SO42– рівновага зміщується у бік зворотного процесу:

Введення одноіменного йона у розчин малорозчинного електроліту зменшує його розчинність.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1359; Нарушение авторских прав?; Мы поможем в написании вашей работы!