
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Водневий показник
|
|
|
|
ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ ВОДИ.
Хімічно чиста вода є надзвичайно слабким електролітом, але дуже незначною мірою вона може піддаватися електролітичній дисоціації (точніше – іонізації):
Н2О Û Н+ + ОН–.
Завдяки малим розмірам йонів Н+ вони миттєво гідратуються з утворенням йонів гідроксонію Н3О+ (рис. 6.6) за схемою:
Н+ + Н2О à H3O+ + OH–, (6.8)
або H2O + H2O Û H3O+ + OH–.
Доведено, що гідратація йонів Н+ – це необоротний процес з константою рівноваги приблизно 10146, тобто йони Н+ гідратуються практично повністю.
Реакція, що відповідає рівнянню 2Н2ОÛН3О++ОН–, називається автопротоліз води, під час якого одна молекула води відщеплює йон Н+ (протон) і відіграє роль кислоти, а друга, яка приєднує протон з утворенням Н3О+, – роль основи (рис. 6.9).
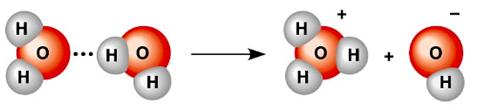
Рисунок 6.9 – Схема автопротолізу води
Однак для зручності при запису дисоціації води користуються скороченим рівнянням:
Н2О Û Н+ + ОН–. (6.9)
На основі експериментальних досліджень встановлено, що при температурі 220С ступінь дисоціації води дуже малий: aН2О=1,8×10–9, тобто на йони розпадається тільки одна молекула із приблизно 1800000000.. Зрозуміло, що вода належить до надзвичайно слабких електролітів і підлягає закону діючих мас. Тому для неї можна записати вираз константи дисоціації:
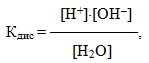
або [H+]×[OH–] = Kдис×[H2O]. (6.10)
Невелике значення ступеня дисоціації води (aН2О=1,8×10–9) свідчить про сильне зміщення рівноваги дисоціації вліво, тому концентрацію H2O при постійній температурі можна вважати постійною. Отже, добуток постійних величин у правій частини рівняння (6.10) – теж величина стала (К×[H2O]=const). Тоді сталим є і добуток концентрацій йонів Н+ і ОН– в лівій частині рівняння. Цей добуток ([H+]×[OH–]) одержав назву іонний добуток води:
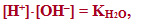
де КН2О – іонний добуток води, для якого прийняті й інші позначення: Кв, або Кw.
Константа дисоціації води, визначена експериментально, при 22оС дорівнює: Кдис=1,8∙10–16, а концентрацію недисоційованих молекул води [H2O] практично можна вважати рівною її загальній концентрації. З рівняння дисоціації води (Н2ОÛН++ОН–) видно, що концентрації катіонів Гідрогену і гідроксильних аніонів однакові і в той же час дорівнюють концентрації тієї частини води, яка продисоціювала і яка визначається добутком a·[H2O]:
[H+] = [OH–] = a[H2O].
Молярна концентрація води обчислюється відношенням кількості речовини (n=m/M) до об’єму V:
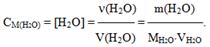
Беручи до уваги, що 1 л води при 220С має масу приблизно 1000 г, одержимо молярну концентрацію води:
[H2O] = m / М×V = 1000 / 18×1= 55,56 моль/л.
Тоді концентрації йонів гідрогену і гідроксид-іонів складають
[H+] = [OH–] = a·[H2O] = 1,8 × 10–9 × 55,56 = 1 × 10–7 моль/л,
звідки іонний добуток води дорівнює:
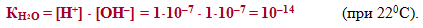
Іонний добуток води є сталою величиною за умов постійної температури. При підвищенні температури КН2О збільшується. Це зумовлено тим, що дисоціація води є ендотермічним процесом, який згідно з принципом Ле-Шательє посилюється із зростанням температури і послаблюється під час охолодження.
Для води і розведених водних розчинів за умов постійної температури добуток концентрацій йонів гідрогену і гідроксид-іонів є величиною сталою:
KH2O = [H+] × [OH–] = 10–14 (220C). (6.11)
Таке саме значення КН2О при 220С мають і розведені водні розчини кислот і основ. Тому, якою б великою не була концентрація йонів Н+, концентрація йонів ОН– не буде дорівнювати нулю або навпаки. На основі (6.11) можна обчислити концентрацію [Н+] чи [OH–], якщо одна з цих величин відома:
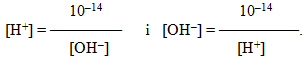 (6.12)
(6.12)
Проте, вести розрахунки концентрацій [H+] i [OH–] через від¢ємний ступінь не зовсім зручно, тому за пропозицією Серенсена використовується інша величина – водневий показник, який позначається символом рН.
Водневий показник рН – це величина, що характеризує кислотність середовища і дорівнює від¢ємному десятковому логарифму концентрації йонів гідрогену [H+]:
рН = –lg[H+]. (6.13)
По аналогії з ним було введено і гідроксильний показник рОН:
pОН = – lg[OH–]. (6.14)
Логарифмуючи рівняння (6.11): [H+] × [OH–] = 10–14), одержимо:
lg [H+] + lg [OH–] = –14.
Якщо перемножити усі члени в останньому рівнянні на –1, то:
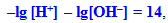 (6.15)
(6.15)
або з урахуванням (6.13) і (6.14):
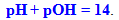 (6.16)
(6.16)
Рівняння (6.15) і (6.16) – це іонний добуток води у логарифмічному вигляді. Розглянемо можливі межі змінення водневого (pH) і гідроксильного (pOH) показників залежно від реакції середовища у розчині.
- У нейтральному середовищі концентрації йонів гідрогену і гідроксил-іонів однакові: [H+] = [OH–] = 10–7, тому водневий показник:
рН = –lg[H+] = –lg10–7 = 7.
- У кислому середовищі концентрація йонів гідрогену завжди вища, ніж концентрація гідроксильних йонів: [H+] > [OH–], тому
[H+] > 7, pН < 7.
- У лужному середовищі, навпаки, переважає концентрація гідроксильних йонів: [H+]<[OH–] i тому
[H+]<10–7, pH > 7.
Розчини, значення рН яких змінюється від 0 до 3, вважаються сильнокислими, а при рН=4-6 – слабкокислими. Слабколужні розчини мають рН=8-10, а сильнолужні – рН=11-14. Якщо [H+]>1моль/л, то рН набуває від¢ємних значень (рис.6.10). Так, при [H+]=2моль/л водневий показник рН= –lg2 = –0,3. Якщо [H+]<10–14моль/л, рН>14, наприклад, при концентрації йонів гідрогену [H+] = 0,5×10–14моль/л, водневий показник рН = 14,3.
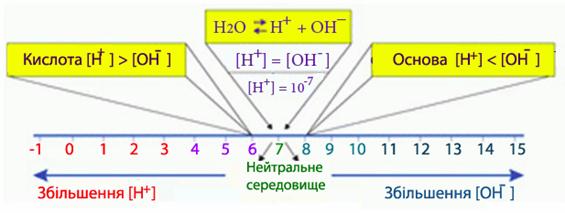
Рисунок 6.10 – Зв'язок між кислотністю середовища и величиною рН
Точне значення рН розчинів можна розрахувати або експериментально визначити за допомогою спеціальних електрохімічних методів. Однак для наближеного знаходження величини рН користуються індикаторами (від лат.слова indicator – той, хто вказує).
Індикатор – це хімічна сполука, яка дозволяє візуалізувати досягнення системою певного стану з відповідною величиною рН середовища, що виявляється у виникненні помітної ознаки (змінення забарвлення, випадіння осаду, поява люмінісценції тощо).
Існує декілька груп індикаторів, кожна з яких має своє призначення. Так, для визначення рН розчину використовують здебільшого кислотно-осн о вні індикатори – найчастіше це складні органічні кислоти чи основи, які змінюють своє забарвлення залежно від реакції середовища. Інтервал значень pH (інтервал переходу), в якому спостерігається змінення забарвлення, пов'язаний з константою диссоціації індикатору (pK) співвідношенням pH=pK±1. Для проведення аналізу індикатор вибирають таким чином, щоб інтервал переходу кольору включав те значення pH, яке розчин має у точці еквівалентності (табл. 6.1, рис. 6.11).
Таблиця 6.1 – Кислотно-осн о вні індикатори
| Назва | Інтервал переходу рН | Забарвлення | |
| у кислому середовищі | у лужному середовищі | ||
| Фенолфталеїн | 8,2-10,0 | Безбарвне | Малинове |
| Метиловий оранжевий | 3,1-4,4 | Рожеве | Жовте |
| Метиловий червоний | 4,2-6,3 | Червоне | Жовте |
| Лакмус | 6,0-8,0 | Червоне | Синє |
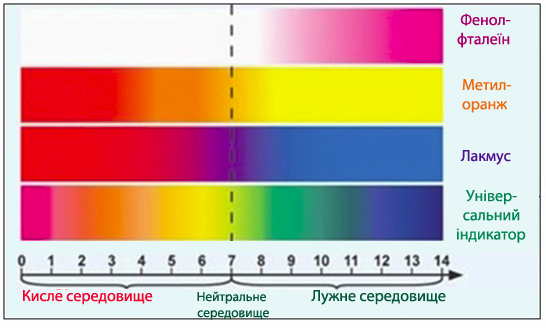
Рисунок 6.11 – Змінення забарвлення деяких індикаторів залежно від рН середовища
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 3603; Нарушение авторских прав?; Мы поможем в написании вашей работы!