
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гідроліз солей
|
|
|
|
РЕАКЦІЇ У РОЗЧИНАХ ЕЛЕКТРОЛІТІВ
Згідно з теорією електролітичної дисоціації реакції у розчинах електролітів відбуваються між йонами, причому обов’язковою умовою перебігу таких реакції є виділення щонайменше одного продукту з реакційного середовища. Реакції між йонами у розчинах відбуваються тільки у тому випадку, якщо внаслідок їх взаємодії утворюється осад, летка сполука або слабкий електроліт, що зумовлює зміщення рівноваги у бік прямої реакції. Розглянемо окремі випадку перебігу іонних реакцій.
1. Утворення осаду. Якщо до розчину солі барію додати розчин, що містить сульфат-йони, то випадає осад BaSO4. Ця взаємодія відображається за допомогою молекулярних та іонних рівнянь реакції:
Ba(NO3)2 + Na2SO4 àBaSO4¯ + 2NaNO3,
Ba2+ +2NO3– + 2Na+ + SO42–àBaSO4¯ + 2Na+ + 2NO3–,
Ba2+ + SO42–àBaSO4¯;
BaCl2 + K2SO4àBaSO4¯ + 2KCl,
Ba2+ + 2Cl– + 2K+ + SO42–àBaSO4¯ + 2K+ + 2Cl–,
Ba2+ + SO42–àBaSO4¯.
Скорочені іонні рівняння доводять, що фактично реакція відбувається між йонами Ва2+ і SO42–, тому саме скорочені іонні рівняння виражають сутність хімізму цієї реакції.
2. Утворення леткої речовини. Прикладами можуть бути реакції, внаслідок яких виділяються газоподібні речовини: H2S, NH3, CO2 тощо.
Na2S + 2HCl à H2S + 2NaCl,
2Na+ + S2– + 2H+ + 2Cl–àH2S + 2Na+ + 2Cl–,
2H+ + S2–àH2S.
3. Утворення малодисоційованих сполук внаслідок перебігу таких процесів:
· реакцій нейтралізації, в яких утворюється вода. Реакції нейтралізації можуть відбуватися при взаємодії
Ø кислоти й основи:
HCl + NaOH à NaCl + H2O,
H+ + Cl– + Na+ + OH–àNa+ + Cl– + H2O,
H+ + OH–àH2O;
Ø кислої солі з лугом:
NaHCO3 + NaOH à Na2CO3 + H2O,
Na+ + HCO3– + Na+ + OH–à2Na+ + CO32– + H2O,
HCO3– + OH–àH2O + CO32–;
Ø осн о вної солі з кислотою:
Fe(OH)2Cl + 2HCl à FeCl3 + 2H2O,
Fe(OH)2+ + Cl– + 2H+ + 2Cl–àFe3+ + 3Cl– + 2H2O,
Fe(OH)2+ +2H+ à Fe3+ + 2H2O;
Ø кислотного оксиду з лугом:
CO2 + 2КOH à К2CO3 + H2O,
CO2 + 2К+ + 2OH–à2К+ + CO32– + H2O,
CO2 + 2OH–àH2O + CO32–;
Ø осн о вного оксиду з кислотою:
СаO + 2HCl à СаCl2 + H2O,
СаО + 2H+ + 2Cl–àСа2+ + 2Cl– + H2O,
СаО +2H+ à Са2+ + H2O;
· реакції, в яких утворюється слабка кислота:
NaClО + HNO3 à NaNO3 + HClО,
Na+ + ClО– + H+ + NO3–àNa+ + NO3– + HClО,
H+ + Cl–àHСlO; (Кдис = 3×10-8)
(СH3COO)2Ca + 2HCl àCaCl2 + 2CH3COOH,
2СH3COO– + Ca2+ + 2H+ + 2Cl– àCa2+ + 2Cl– + 2CH3COOH,
СH3COO– + H+ à CH3COOH; (Кдис = 1,78 ×10-5);
· реакції утворення слабкої основи:
NH4Cl + NaOH à NaCl + NH4OH,
NH4+ + Cl– + Na+ + OH–àNa+ + Cl– + NH4OH,
NH4+ + OH–àNH4OH; (Кдис = 1,76 × 10-5);
· реакції утворення комплексних йонів:
Zn(OH)2 + 2KOH àK2[Zn(OH)4],
Zn(OH)2 + 2K+ + 2OH–à2K+ + [Zn(OH)4]2–,
Zn(OH)2 + 2OH– à [Zn(OH)4]2–; (Кдис = 2×10-4).
Більшість солей у водних розчинах не тільки піддається процесу гідратації, внаслідок якої катіони й аніони оточуються диполями води, але й процесу гідролізу – взаємодії з водою.
Гідроліз солей – це взаємодія складових частин солі з водою, яка приводить до утворення слабкого електроліту: кислоти чи основи, кислої чи основної солі.
Гідроліз являє собою реакцію обмінного розкладання солі водою, тобто процес, який є зворотним відносно реакції нейтралізації. Гідроліз – рівноважна реакція, тому можна зміщувати рівновагу у бажаний бік, створивши такі умови, за яких сіль або піддається повному гідролізу, або, навпаки, зовсім не буде гідролізуватися.
Якщо розглядати солі як продукти взаємодії кислот з основами, то в залежності від сили кислот і основ розрізняють чотири типи солей:
· солі, що утворені сильною кислотою і сильною основою;
· солі, що утворені слабкою кислотою і сильною основою;
· солі, що утворені сильною кислотою і слабкою основою;
· солі, що утворені слабкою кислотою і слабкою основою.
Сіль, що складається з катіонів сильних основ і аніонів сильних кислот (NaCl, KNO3, Na2SO4 тощо), ніколи не гідролізується, оскільки катіони і аніони таких солей не зв’язують складові частини води (Н+ і ОН–), а отже, не порушують її іонну рівновагу. Тому концентрація йонів Н+ і ОН– залишається звичайно такою, як у чистої води, а розчин має нейтральне середовище (рН=7). Отже, при розчиненні таких солей відбувається тільки їх дисоціація. Наприклад:
NaCl à Na+ + Cl–,
KNO3 à K+ + NO3–.
Солі, утворені сильною основою та сильною кислотою, гідролізу не піддаються.
При гідролізі солей інших типів у розчині спостерігається змінення реакції середовища.
Ще раз слід наголосити, що в реакцію гідролізу вступають лише ті солі, які містять кислотні залишки слабких кислот чи катіони слабких основ. Залежно від природи солі гідроліз поділяють на три типи.
І тип – гідроліз солей, утворених сильними основами і слабкими кислотами, тобто гідроліз по аніону. До таких солей належать Na2CO3, CH3COONa, KCN, K3PO4, Na2S та інші. Якщо сіль містить однозарядний кислотний залишок, то реакція гідролізу відбувається в одну стадію, наприклад, гідроліз натрій ацетату:
СН3СООNa + H2O Û CH3COOH + NaOH,
СН3СОО– +Na+ + H2O Û CH3COOH + Na+ + OH–,
СН3СОО– + H2O Û CH3COOH + OH–.
Із скороченого іонного рівняння видно, що йони Na+ не беруть участі в реакціїї – гідролізується лише аніон СН3СОО–, який зв’язує одну із складових частин води і утворює малодисоційовану сполуку – слабку оцтову кислоту СН3СООН. При цьому у розчині накопичується надлишок незв’язаних гідроксид-іонів, який забезпечує лужну реакцію середовища і рН>7.
Оскільки гідроліз є оборотним процесом, то він підкоряється закону діючих мас і характеризується константою рівноваги:

Проте у розведених розчинах, в яких і відбувається гідроліз, кількість води порівняно з кількістю солі дуже велика, тому концентрацію води можна вважати постійною ([H2O] = const) і об'єднати її з константою рівноваги:
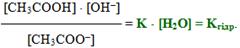
Добуток у правій частині одержаного рівняння (К·[H2O]) називається константа гідролізу. Помножимо чисельник і знаменник лівої частини рівняння на [H+]:
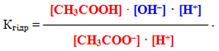
Однак добуток [H+]·[OH–] – це іонний добуток води (KH2O):
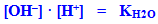 ,
,
а інша частина рівняння – вираз, оборотний константі дисоціації слабкої оцтової кислоти:
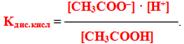
З урахуванням цього одержуємо:

Якщо у складі солі є багатозарядний аніон слабкої кислоти, то така сіль гідролізується ступінчасто, причому, на першому ступені утворюються кислі солі, наприклад, гідроліз натрій карбонату:
I ступінь: Na2CO3 + H2O Û NaHCO3 + NaOH,
2Na+ + CO32– + H2O Û Na+ + HCO3– + Na+ + OH–,
CO32– + H2O Û HCO3– + OH–;
ІІ ступінь: NaНCO3 + H2O Û H2CO3 + NaOH,
Na+ + НCO3– + H2O Û H2CO3 + Na+ + OH–,
НСО3– + Н2О Û Н2СО3 + ОН–.
Завдяки наявності незв’язаних йонів ОН– у розчини цієї солі утворюється лужне середовище, рН>7.
За звичайних умов гідроліз, як правило, обмежується першою стадією, оскільки йони ОН–, що вивільняються під час першої стадії, зміщують згідно із принципом Ле-Шательє гідролітичну рівновагу другої стадії у бік зворотної реакції.
До такого самого висновку можна дійти, порівнюючи величини констант дисоціації кислот НСО3– і Н2СО3, які утворюються відповідно на першій та другій стадіях гідролізу: КНСО3–=4,8×10–11; КН2СО3=4,5×10–7. Зрозуміло, що сіль Na2CO3, що утворена слабкішою кислотою НСО3–, буде гідролізуватися сильніше, ніж сіль NaHCO3, що утворена менш слабкою кислотою Н2СО3. Отже, Кгідр Na2CO3>Kгідр NaHCO3. Однак, якщо з якихось причин необхідно посилити гідроліз, можна додати невелику кількість кислоти для зв’язування гідроксид-іонів (Н++ОН–àН2О) або сильніше розвести розчин: збільшення кількості Н2О зміщує рівновагу вправо. Нарешті, зважаючи на те, що гідроліз належить до ендотермічних процесів, для зміщення рівноваги у напрямку прямої реакції необхідно підвищити температуру.
Із розглянутих прикладів випливає висновок щодо І типу гідролізу: cіль, утворена сильною основою і слабкою кислотою, гідролізується по аніону, при цьому утворюється слабка кислота (чи кисла сіль), а розчин набуває лужної реакції середовища (рН>7). Вираз константи гідролізу за І типом доводить: чим менше значення константи дисоціації кислоти (тобто чим слабкіша кислота), тим більша величина Кгідр і тим сильніше гідролізується сіль.
ІІ тип – гідроліз солей, утворених слабкими основами і сильними кислотами, тобто гідроліз по катіону. Прикладами таких солей є: NH4NO3, FeCl2, FeCl3, Al(ClO4)3, CuSO4 та ін. При однозарядному катіоні гідроліз відбувається в одну стадію:
NH4Сl + H2O Û NH4OH + HCl,
NH4+ + Сl– + H2O Û NH4OH + H+ + Cl–,
NH4+ + H2O Û NH4OH + H+.
Надлишок йонів Н+ зумовлює кислу реакцію середовища і рН<7.
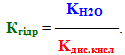
Константа гідролізу, що описує гідролітичну рівновагу, для цієї солі має вигляд:
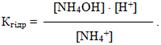
Перемножимо чисельник і знаменник рівняння на [OH–]:
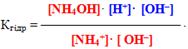
Одержане рівняння складається з йонного добутку води і константи дисоціації основи

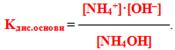
Тоді маємо ще один вираз константи гідролізу:
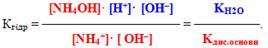
Для гальмування гідролізу солей цього типу необхідно підкислити розчин (збільшення концентрації Н+ згідно із принципом Ле-Шательє зміщує рівновагу вліво) чи підвищити концентрацію солі, оскільки зменшення кількості Н2О теж буде сприяти протіканню зворотної реакції. Можна також знизити температуру.
Якщо сіль має багатозарядний катіон, гідроліз відбувається ступінчасто:
I ступінь: CuCl2 + H2O Û CuOHCl + HCl,
Cu2+ + 2Cl– + H2O Û CuOH+ + Cl– + H+ + Cl–,
Cu2+ + H2O Û CuOH+ + H+;
II ступінь: CuOHCl + H2O Û Cu(OH)2 + HCl,
CuOH+ + Cl–+ H2O Û Cu(OH)2 + H+ + Cl–,
CuOH+ + H2O Û Cu(OH)2 + H+.
Надлишок йонів Н+ свідчить про кислу реакцію середовища і рН<7. Кожній стадії відповідає своя константа гідролізу:
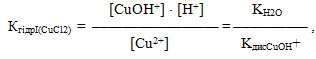
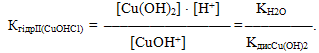
Оскільки Кдис Cu(OH)2>Kдис CuOH+, то КгідрІ>КгідрІІ, тобто за першим ступенем сіль гідролізується значно більше, ніж за другим. Отже, висновок щодо ІІ типу гідролізу: сіль, утворена слабкою основою і сильною кислотою, гідролізується по катіону, при цьому утворюється слабка основа (чи осн о вна сіль), а розчин набуває кислої реакції середовища, рН<7. Вираз константи гідролізу показує: чим слабкішою є основа (або чим менше значення Кдис.осн), тим більша константа гідролізу і тим сильніше гідролізується сіль
ІІІ тип – гідроліз солей, утворених слабкими кислотами і слабкими основами. Гідроліз таких солей протікає досить повно, а іноді й необоротно, оскільки внаслідок гідролізу утворюються дві малодисоційовані, леткі чи малорозчинні сполуки. Реакція середовища у розчині солей цього типу найчастіше буває нейтральною (рН≈7), але може бути слабкокислою (рН£7), або слабколужною (рН³7).
Розглянемо кожний з таких випадків. Гідроліз ацетату амонію:
СН3СООNH4 + H2O Û CH3COOH + NH4OH,
СН3СОО– + NH4+ + H2O Û CH3COOH + NH4OH,
CH3COO– + NH4+ + H2O Û CH3COOH + NH4OH.
Внаслідок гідролізу ацетату амонію утворюються слабка кислота CH3COOH і слабка основа NH4OH. Для того, щоб зробити висновок про рН розчину солі СН3СООNH4, необхідно порівняти сили обох слабких електролітів за їх константами дисоціації:
Кдис.СН3СООН = 1,74 × 10–5; Кдис.NH4OH = 1,76 × 10–5.
Обидві константи практично однакові, тому розчин солі СН3СООNH4 має нейтральну реакцію середовища, рН=7. Для цього типу солей константа гідролізу ураховує константи дисоціації як кислоти, так і основи:
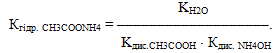
Прикладом другого випадку, при якому розчин набуває слабкокислого середовища, є гідроліз Меркурій (ІІ) ціаніду:
І ступінь: Hg(CN)2 + H2O Û HgOHCN + HCN,
Hg2+ + 2CN– + H2O Û HgOH+ + CN– + HCN,
Hg2+ + H2O Û HgOH+ + HCN,
ІІ ступінь: HgOHCN + H2O Û Hg(OH)2 + HCN,
HgOH+ + CN– + H2O Û Hg(OH)2 + HCN,
HgOH+ + CN– + H2O Û Hg(OH)2 + HCN.
Необхідно уточнити, що на практиці основа Hg(OH)2 дуже швидко розкладається на HgO i H2O, але в наведеному прикладі це не показано.
Порівняємо константи дисоціації відповідних електролітів:
Кдис.Hg(OH)2 = 5 × 10–11, Kдис.HgOH+ = 3,6 × 10–14, Кдис.HCN = 5 × 10–10.
Величина Кдис.HCN на порядок перебільшує Кдис.Hg(OH)2, а це свідчить, що основа Hg(OH)2 по силі електроліта слабкіша, ніж електроліт HCN. З цієї причини гідроліз по катіону певною мірою переважає над гідролізом по аніону, зв’язування йонів ОН– відбувається значніше, тому реакція середовища – слабкокисла і рН£7.
Слабколужне середовище може утворюватися, наприклад, при гідролізі солі плюмбум (ІІ) ацетату Pb(CH3COO)2:
І ступінь: Pb(CH3COO)2 + H2O Û (PbOH)(CH3COO) + CH3COOH,
Pb2+ + 2CH3COO– + H2O Û PbOH+ + CH3COO– + CH3COOH,
Pb2+ + CH3COO– + H2O Û PbOH+ + CH3COOH.
ІІ ступінь: PbOHCH3COO + H2O Û Pb(OH)2 + CH3COOH,
PbOH+ + CH3COO– + H2O Û Pb(OH)2 + CH3COOH.
Для визначення рН порівняємо константи дисоціації відповідних електролітів:
КPbOH+ = 9,6 × 10–4; KCH3COOH = 1,74 × 10–5.
Оскільки кислота є значно слабшим електролітом, то реакція середовища у розчині солі Pb(CH3COOН)2 слабколужна, рН³7.
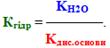
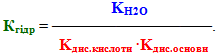
На підставі розглянутих прикладів можна зробити висновок щодо ІІІ типу гідролізу: Сіль, утворена слабкою основою та слабкою кислотою, гідролізується одночасно по катіону і по аніону, при цьому продуктами є слабка основа (або осн о вна сіль) і слабка кислота (або кисла сіль). Реакція середовища у розчині може бути: 1) нейтральною (рН≈7), якщо основа і кислота мають близькі значення констант дисоціації (Кдис.кислоти≈Kдис.основи); 2) слабкокислою (рН£7), якщо основа є слабкішим електролітом у порівнянні з кислотою (Кдис.кислоти > Kдис.основи); 3) слабколужною (рН³7), якщо кислота є слабкішим електролітом, ніж основа (Кдис.кислоти < Kдис.основи). Константа гідролізу визначається константами дисоціації як слабкої кислоти, так і слабкої основи:
Деякі солі, що утворені дуже слабкими кислотами і дуже слабкими основами, гідролізуються не ступінчасто, а одразу піддаються повному необоротному гідролізу. Наприклад, алюміній сульфід, утворений слабкою амфотерною основою Al(OH)3 і слабкою сульфідною кислотою H2S, гідролізується майже миттєво навіть у невеликій кількості води, причому, гідроліз одночасно протікає і по катіону, і по аніону:
Al2S3 + 6H2O à 2Al(OH)3¯ + 3H2S.
Кількісною мірою гідролізу, крім константи гідролізу, може бути й інша характеристика – ступінь гідролізу h.
Ступінь гідролізу h – це відношення концентрації гідролізованої солі до її загальної концентрації:
h = Cгідр / Сзаг.
Для дуже розведених розчинів солей виконується залежність, аналогічна рівнянню Оствальда, яка пов’язує ступінь гідролізу з концентрацією і константою гідролізу:
Кгідр = Сh2 i 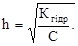
В повсякденній практиці слід пам’ятати, що розчини багатьох солей можуть мати значення рН, відмінні від 7, а це визначає особливості протікання тих чи інших хімічних реакцій і, зокрема, агресивність середовища при корозійних процесах. Крім того, необхідно знати засоби, за допомогою яких гідроліз може посилюватися чи пригнічуватися.
Чинники, що впливають на ступінь гідролізуh і зміщення гідролітичної рівноваги.
· Природа солі: чим слабкіша кислота, аніон якої входить до складу солі, тим повніше відбувається гідроліз; чим слабкішою є основа, катіон якої входить до складу солі, тим більшою є величина ступеню гідролізу h. Наприклад, з двох солей КClO і КCN, які гідролізуються по аніону, за однакових умов більшою мірою піддається гідролізу КCN, оскільки кислота HCN слабкіша за НClO (KHCN=7,9 . 10–10, KHClO=5 . 10–8). А з двох солей MgCl2 і ZnCl2 більше гідролізується ZnCl2, тому що ця сіль утворена слабкішою основою Zn(OH)2.
· Концентрація солі, яка безпосередньо зв'язана з кількістю води у розчині. В розведеніших розчинах води набагато більше, ніж у концентрованих. А згідно з принципом Ле-Шательє збільшення кількості води (розведення розчину) зміщує гідролітичну рівновагу вправо. Звідси випливає загальний висновок: при розведенні розчину гідроліз солей посилюється і ступінь гідролізу h зростає, а при концентруванні – гідроліз послаблюється.
· Температура. Оскільки реакція гідролізу належить до ендотермічних процесів, то підвищення температури зміщує гідролітичну рівновагу вправо і ступінь гідролізу зростає.
· Змінення реакції середовища шляхом додавання до розчину солі кислоти (+Н+) або лугу (+ОН–). При гідролізі по аніону, у результаті якого відбувається накопичення у розчині незв'язаних йонів ОН–, додавання лугу відповідно до принципу Ле-Шательє зміщує гідролітичну рівновагу вліво і гідроліз пригнічується. А підкислення розчину такої солі (введення додаткових йонів Н+) зв’язує вільні гідроксильні йони в малодисоційовану сполуку (Н++ОН–àН2О) і зміщує гідролітичну рівновагу вправо, посилюючи перебіг гідролізу. Наприклад, якщо розчин солі Na2CO3, що створює лужну реакцію середовища за рахунок незв'язаних йонів ОН–, підкислити, то гідроліз посилиться, а якщо долити трохи лугу – послаблюється. Для солей, які гідролізуються по катіону і створюють у розчині кисле середовище, справедливою є зворотна залежність: підкислення пригнічує гідроліз, а додавання лугу – посилює.
· Додавання інших солей. Якщо до розчину солі, що гідролізується, долити розчин іншої солі, гідроліз якої відбувається за тим же типом і створює таке ж середовище (кислотне чи лужне), то спостерігається взаємне пригнічування гідролізу, оскільки обидві солі збільшують концентрацію однакових продуктів реакції (Н+ чи ОН–), а це призводить до зміщення гідролітичної рівноваги вліво, у бік зворотної реакції. А при зливанні розчинів двох солей, які гідролізуються за різними типами (тобто гідроліз однієї солі сприяє накопиченню надлишку йонів Н+, а гідроліз другої – надлишку йонів ОН–), відбувається взаємне посилення гідролізу. Зміщування гідролітичної рівноваги вправо, у бік прямої реакції, особливо помітно у достатньо розведених розчинах – в цьому випадку відбувається сумісний необоротний гідроліз, який, як правило, не обмежується першою стадією, а відбувається до кінця, до утворенні кінцевих продуктів. Наприклад, при змішуванні розведеного розчину хром(Ш) сульфату, який гідролізується по катіону, і натрій сульфіду, гідроліз якого відбувається по аніону, починається сумісний необоротний гідроліз обох солей, причому і катіон, і аніон гідролізуються до кінця, тому в рівнянні реакції сумісного необоротного гідролізу ставлять стрілку (à):
Cr2(SO4)3 + 3Na2S + 6H2O à 2Cr(OH)3¯ + 3H2S + 3Na2SO4,
2Cr+ + 3SO42– + 6Na+ + 6H2O à 2Cr(OH)3¯ + 3H2S + 6Na+ + SO42–,
2Cr3+ + 3S2– + 6H2O à 2Cr(OH)3¯ + 3H2S.
Як видно з рівнянь гідролізу, йони Н+ і ОН– сполучаються у міцні недисоційовані сполуки (осад Cr(OH)3 і летка речовина H2S), тому реакція середовища нейтральна і рН=7.
Гідроліз відіграє важливу роль при здійсненні багатьох процесів. Наприклад, вилучення солей феруму з води методом аерації при очищенні питної води. При насиченні води киснем ферум (II) гідрогенкарбонат, що міститься у воді, окиснюється до солі феруму (III), який сильніше піддається гідролізу. У результаті відбувається повний гідроліз і залізо відокремлюється у вигляді осаду ферум (III) гідроксиду. На цьому засновано й застосування солей Алюмінію в якості коагулянтів при очищенні питної води. Солі Алюмінію в присутності гідрогенкарбонат-йонів повністю гідролізуються, утворюючи драглистий осад алюміній гідроксиду, який при коагуляції захвачує в осад ще й інші домішки.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 37911; Нарушение авторских прав?; Мы поможем в написании вашей работы!