
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Приклади розв'язання типових задач
|
|
|
|
Приклад 6.1. Написати рівняння дисоціації основ: калій гідроксиду і ферум (ІІ) гідроксиду, скласти вираз константи дисоціації.
Розв’язок. Калій гідроксид – луг, належить до сильних електролітів і піддається у розчинах повній дисоціації:
KOH à K+ + OH–.
Оскільки КОН є сильним електролітом, він не підкоряється закону діючих мас і константа дисоціації для нього не записується.
Ферум (ІІ) гідроксид, навпаки, є слабким електролітом, дисоціює по двом ступеням, кожному з яких відповідає свій вираз константи дисоціації:

Приклад 6.2. Скласти рівняння електролітичної дисоціації для таких речовин: а) хлоридна кислота; б) ортоарсенатна кислота; в) купрум(ІІ) гідроксид; г) ферум(ІІІ) сульфат; д) кальцій дигідрогенортофосфат; е) гідроксокупрум(ІІ) хлорид.
Розв’язок. а) хлоридна (соляна) кислота – сильний електроліт, тому в водних розчинах дисоціює повністю
 ;
;
б) ортоарсенатна кислота – слабкий електроліт, трьохосновна кислота, тому дисоціація відбуваєтьсяь частково, у три стадії, причому ступені дисоціації для окремих стадій перебувають в залежності h1>h2>h3. Рівняння дисоціації:
I ступінь: 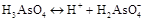 ,
,
II ступінь:  ,
,
III ступінь: 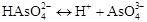 ;
;
в) купрум (ІІ) гідроксид – слабкий електроліт, піддається частковій дисоціації по двом ступеням:
I ступінь:  ,
,
II ступінь:  ;
;
г) ферум(ІІІ) сульфат – сильний електроліт, добре розчинна сіль, тому дисоціює повністю, в одну стадію:
 ;
;
д) кальцій дигідрогенортофосфат – кисла сіль, яка по першому ступеню дисоціює повністю як сильний електроліт, а по другій і третій – тільки частково, як слабкий електроліт:
I ступінь:  ,
,
II ступінь:  ,
,
III ступінь: 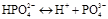 ;
;
е) гідроксокупрум(ІІ) хлорид – основна сіль, по першому ступеню дисоціює повністю, а по другому – частково:
I ступінь: 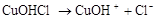 ,
,
II ступінь:  .
.
Приклад 6.3. Як буде зміщуватися рівновага у розчині оцтової кислоти при додаванні до нього солі СН3СООNa?
Розв¢язок. Оцтова кислота, яка є слабким електролітом, частково дисоціює на йони за рівнянням:
СН3СООН Û СН3СОО– + Н+.
Якщо до її розчину додати сильний електроліт – сіль СН3СООNa, то внаслідок майже повної дисоціації цієї солі зв¢являється велика кількість йонів СН3СОО–:
СН3СООNa à CH3COO– + Na+.
Ацетат-аніони будуть утворювати з катіонами Н+ недисоційовані молекули:
СН3СОО– + Н+ à CH3COOH,
тобто концентрація оцтової кислоти буде зростати. А з підвищенням концентрації ступінь дисоціації зменшується, тому рівновага процесу дисоціації вихідної кислоти СН3СООН зміститься у напрямку зворотньої реакції.
Приклад 6.4. Розрахувати рН розчинукалій гідроксиду КОН концентрації 0,01 моль/л.
Розв¢язок. Калій гідроксид належить до сильних електролітів, тому в розведених розчинах дисоціює повністю:
КОН à K+ + OH–.
Як випливає з рівняння дисоціації, концентрація гідроксильних йонів дорівнює концентрації КОН, тобто
[OH– ] = CМ(KOH) = 0,01 моль/л = 10–2 моль/л.
Гідроксильний показник, який визначається від¢ємним логарифмом концентрації йонів ОН–, пов¢язаний з водневим показником співвідношенням
рН + рОН = 14,
звідки рН = 14 – рОН.
Однак, рОН = – lg[OH–] = –lg10–2 = 2, тому
рН = 14 – 2 = 12.
Це вказує на сильнолужне середовище.
Приклад 6.5. Обчислити ступінь дисоціації і концентрацію йонів Гідрогену в розчині оцтової кислоти концентрації 0,1М, якщо Кдис = 1,8 × 10–5.
Розв¢язок. Оцтова кислота належить до слабких електролітів, дисоціює частково:
СН3СООН Û СН3СОО– + Н+,
тому для неї концентрація йонів Гідрогену визначається добутком ступеня дисоціації на загальну концентрацію кислоти
[H+] = a × CCH3COOH,
а ступінь дисоціації обчислюється згідно із законом розведення Оствальда:
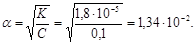
Тоді концентрація йонів Гідрогену:
[H+] = 1,34 × 10–2 × 0,1 = 1,34 × 10–3 моль/л.
Приклад 6.6. Як буде зміщуватися рівновага у насиченому розчині ВаСl2 при додаванні соляної кислоти?
Розв¢язок. Рівняння дисоціації солі та добуток розчинності:
ВаСl2 à Ba2+ + 2Cl–;
ДРBaCl2= [Ba2+]×[Cl–]2.
Збільшення концентрації Cl– при додаванні HСl зміщує рівновагу дисоціації солі BaCl2 вліво, внаслідок чого починається кристалізація осаду:
Ba2+ + 2Cl– à BaCl2(кр).
Приклад 6.7. Написати рівняння реакцій між розчинами ферум(ІІІ) хлориду і натрій гідроксиду в молекулярній та йонній формах.
Розв¢язок. Запишемо рівняння реакції в молекулярній формі, відмітивши випадіння осаду:
FeCl3 + 3NaOH à Fe(OH)3↓+ 3NaCl
Складемо розгорнуте йонне рівняння, записуючи формули сильних електролітів у вигляді йонів, а малодисоційованих сполук – у молекулярній формі:
Fe3+ + 3Cl– + 3Na+ + 3OH– à Fe(OH)3 ¯ + 3Na+ + 3Cl–.
Скоротимо з обох частин йонного рівняння однакові йони, які не беруть участі в реакції (їх формули підкреслені):
Fe3+ + 3Cl – + 3Na + + 3OH– à Fe(OH)3¯ + 3Na + + 3Cl –.
Запишемо скорочене йонне рівняння реакції в остаточному вигляді:
Fe3+ + 3OH– à Fe(OH)3¯.
Як видно з цього рівняння, суть реакції зводиться до взаємодії між йонами Fe3+ і OH–, внаслідок чого утворюється осад Fe(OH)3. При цьому зовсім не має значення, до складу яких електролітів входили ці йони до їх взаємодії.
Приклад 6.8. Які з вказаних пар йонів можуть одночасно знаходитися в розчині: а) Na+ і PO43–;б) Na+ і OH–; в) Ag+ і Cl–; г) Cu2+ і S2–?
Розв’язок. Одночасно знаходитися в розчині можуть лише такі йони, що разом утворюють сильні електроліти: сильні основи та кислоти, розчинні у воді солі.
а) пара йонів Na+ і PO43– є складовими розчинної у воді солі (Na3PO4), яка є сильним електролітом і повністю розпадається на йони; отже ці йони можуть одночасно знаходитися в розчині;
б) йони Na+ і OH– відповідають сильній основі, отже вони також можуть одночасно існувати в розчині;
в) йони Ag+ і Cl– не можуть одночасно знаходитися у розчині, тому що разом вони утворюють нерозчинну сіль згідно із схемою:
Ag+ + Cl–à AgCl↓;
г) йони Cu2+ і S2– теж не можуть одночасно знаходитися у розчині, тому що разом вони утворюють нерозчинний у воді осад – сіль купрум(ІІ) сульфід:
Cu2+ + S2– à CuS↓.
Приклад 6.9. Написати молекулярні та йонні рівняння реакцій (для тих випадків, коли вони відбуваються) при зливанні розчинів таких речовин: а) калій сульфіду і хлоридної кислоти; б) аргентум нітрату і калій ортофосфату; в) купрум(ІІ) гідроксиду і нітратної кислоти; г) натрій гідрогенкарбонату і сульфатної кислоти; д) барій гідроксиду і натрій гідроксиду.
Розв’язок. При виконанні подібних завдань необхідно підтримуватися наступного алгоритму.
1. Спрогнозувати склад очікуваних продуктів реакції обміну з урахуванням перебігу необоротної взаємодії між вихідними реагентами (випадіння осаду,виділення газу чи утворення малодисоційованої сполуки) і зробити висновок про можливість або неможливість протікання хімічної реакції.
2. При принциповій можливості протікання реакції записати молекулярне рівняння, розставити необхідні коефіцієнти.
3. На основі молекулярного рівняння скласти повне йонне рівняння реакції, в якому формули сильних електролітів записувати у вигляді йонів, а неелектролітів, осаду і газу – в молекулярному.
4. Записати скорочене йонне рівняння, попередньо скоротивши зліва і справа формули одних і тих самих йонів і залишивши тільки формули тих йонів і молекул, які брали участь у хімічнії взаємодії.
а) 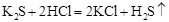 (молекулярне рівняння),
(молекулярне рівняння),
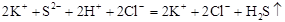 (повне йонне рівняння),
(повне йонне рівняння),
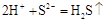 (скорочене йонне рівняння);
(скорочене йонне рівняння);
б) 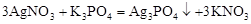 ,
,
 ,
,
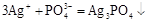 ;
;
в) 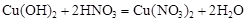 ,
,
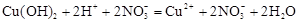 ,
,
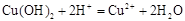 ;
;
г)  ,
,

 ;
;
д) якщо уявити можливість перебігу реакції між двома сильними електролітами BaCl2 і NaOH, то її продуктами були б речовини Ba(OH)2 і NaCl. Але вони теж є сильними електролітами, тобто перебувають у розчині у вигляді йонів. Отже, не виконується умова необоротності, тому взаємодія між BaCl2 і NaOH не відбуваєтьсяь.
Приклад 6.10. Скласти молекулярні рівняння реакцій для запропонованих скорочених схем:
а)  ; б)
; б) 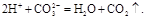
Розв’язок. Для складання молекулярного рівняння реакції згідно із заданим йонним рівнянням необхідно підібрати відповідні сильні електроліти, при дисоціації яких у водних розчинах утворюються зазначені йони.
а) очевидно, що катіони 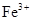 утворюються внаслідок дисоціації сильних електролітів, до яких належить більшість добре розчинних солей феруму(III), а гідроксид-іони – внаслідок дисоціації лугів (за винятком слабкого електроліту NH4OH). Тому в якості молекулярного рівняння можна вибрати такі варіанти:
утворюються внаслідок дисоціації сильних електролітів, до яких належить більшість добре розчинних солей феруму(III), а гідроксид-іони – внаслідок дисоціації лугів (за винятком слабкого електроліту NH4OH). Тому в якості молекулярного рівняння можна вибрати такі варіанти:
Fe(NO3)3 + 3KOH à Fe(OH)3¯ + 3KNO3,
FeCl3 + 3KOH à Fe(OH)3¯ + 3KCl.
б) за скороченим йонним рівнянням можна припустити, що катіони Н+ утворюються у результаті дисоціації сильної кислоти, а аніони СО32– – при дисоціації розчинної карбонатної солі. Тому заданому йонному рівнянню можуть відповідати такі молекулярні рівняння:
2HCl + K2CO3 à 2KCl + CO2↑ + H2O,
H2SO4 + Na2CO3 à Na2SO4 + CO2↑ + H2O.
Приклад 6.11. Скласти молекулярні та йонно-молекулярні рівняння реакцій, що протікають при змішуванні розведених розчинів (попарно): Cr(NO3)3, K2S, KOH, HCl.
Розв¢язок. Спочатку розглянемо, які процеси будуть відбуватися, якщо до розчину, що містить Cr(NO3)3, додавати по черзі решту розчинів.
a) змішування водних розчинів Cr(NO3)3 i K2S призведе до протікання необоротного сумісного гідролізу, оскільки зазначені солі гідролізуються за протилежними типами, посилюючи гідроліз одна одної:
2Cr(NO3)3 + 3K2S + 6H2O à2Cr(OH)3¯ + 3H2S + +6KNO3,
2Cr3+ + 6NO3– + 6K+ + 3S2– + 6H2O à 2Cr(OH)3¯ + 3H2S + 6K+ + 6NO3–,
2Cr3+ + 3S2– + 6H2O à 2Cr(OH)3 + 3H2S.
б) при змішуванні розчинів Cr(NO3)3 та КОН залежно від стехіометричного співвідношення реагентів можуть відбуваєтьсяи реакції з утворенням різних продуктів, наприклад,
кислої солі: Cr(NO3)3 + 2KOH à Cr(OH)2(NO3)¯ + 2KNO3,
Cr3+ + 3NO3– + 2K+ + 2OH–à Cr(OH)2(NO3)¯ + 2K+ + 2NO3–,
Cr3+ + NO3– + 2OH– à Cr(OH)2(NO3)¯;
основи: Cr(NO3)3 + 3KOH à Cr(OH)3¯ + 3KNO3,
Cr3+ + 3NO3– + 3K+ + 3OH–àCr(OH)3 ¯ + 3K+ + 3NO3–,
Cr3+ + 3OH–àCr(OH)3,
комплексної солі: Cr(NO3)3 + 6KOH(надл.) àK3[Cr(OH)6] + 3KNO3,
Cr3+ + 3NO3– + 6K+ + 6OH–à3K+ + [Cr(OH)6]3– + 3K+ + 3NO3–,
Cr3+ + 6OH–à [Cr(OH)6] 3–.
в) При додаванні до розчину K2S розчину лугу КОН реакція не відбувається, а при дії на цю сіль розчином хлоридної кислоти HCl утворюється слабка сульфідна кислота чи, більш імовірно, виділяється сірководень:
K2S + 2HCl à 2KCl + H2S,
2K+ + S2– + 2H+ + 2Cl–à2K+ + 2Cl– + H2S ,
2H+ + S2–àH2S.
г) При змішуванні розчинів лугу і кислоти відбуваєтьсяь реакція нейтралізації:
KOH + HCl à KCl + H2O,
K+ + OH– + H+ + Cl–àK+ + Cl– + H2O,
H+ + OH–àH2O.
д) Між сполуками Cr(NO3)3 i HCl при змішуванні їх розчинів взаємодії не відбувається, оскільки обидві речовини належать до сильних електролітів, як і ті сполуки, що могли б утворитися, якщо б реакція була можливою:
Cr(NO3)3 + 3HCl Û CrCl3 + 3HNO3, (реакція не відбуваєтьсяь)
Cr3+ + 3NO3– + 3H+ + 3Cl– Û Cr3+ + 3Cl– + 3H+ + 3NO3–.
З наведеної схеми видно, що взаємодія між розчинами Cr(NO3)3 та HCl не відбувається, тому що у розчині містяться тільки йони (Cr3+, NO3–, H+. Cl–), протікання реакції між якими неможливе, оскільки не забезпечується умова необоротності.
Приклад 6.12. Скласти рівняння реакцій гідролізу солей а) Al2(SO4)3; б) Na2SO3; в) Al2(CO3)3 у молекулярній та йонно-молекулярній формах, вказати реакцію середовища у розчині та зазначити способи посилення гідролізу для солей Na2SO3 і Al2(SO4)3.
Розв¢язок. Для складання рівнянь гідролізу необхідно спочатку встановити складові частини кожної солі і залежно від їх природи визначити тип гідролізу.
а) алюміній сульфат Al2(SO4)3 – сіль, утворена слабкою основою та сильною кислотою, гідролізується у три стадії по катіону (Al3+), який належить слабкій основі. Слід підкрестити, що за звичайних умов протікання гідролізу обмежується тільки першою стадією, а друга, тим паче третя, майже не спостерігається.
І ступінь: Al2(SO4)3 + 2H2O Û 2AlOHSO4 + H2SO4,
2Al3+ +3SO42– + 2H2O Û 2AlOH2++ 2SO42–+ 2H+ + SO42–,
Al3+ + H2O Û AlOH2+ + H+.
Як видно зі скороченого йонного рівняння, внаслідок гідролізу в розчині з¢являється надлишок йонів Н+, що зумовлює кислу реакцію середовища рН<7.
ІІ ступінь: 2AOHSO4 + 2H2O Û (Al(OH)2)2SO4 + H2SO4,
2AlOH2++2SO42–+2H2O Û 2Al(OH)2++SO42–+ 2H++ SO42–,
AlOH2+ + H2O Û Al(OH)2+ + H+.
ІІІ ступінь: (Al(OH)2)2SO4 + 2H2O Û 2Al(OH)3¯ + H2SO4,
2Al(OH)2+ + SO42– + 2H2O Û 2Al(OH)3¯ + SO42– + 2H+,
Al(OH)2+ + H2O Û Al(OH)3¯ + H+.
Посилити гідроліз Al2(SO4)3 можна за допомогою таких заходів:
- розведення розчину шляхом додавання води, що призводить до зміщування гідролітичної рівноваги вправо;
- додавання лугів, які будуть зв¢язувати йони Н+, утворені внаслідок гідролізу, що теж спричиняє зміщення гідролітичної рівноваги;
- підвищення температури – згідно з принципом Ле-Шательє гідроліз, який належить до ендотермічних реакцій, буде посилюватися;
- додавання розчину іншої солі, яка гідролізується за протилежним типом (Na2CO3, Na2S, NaCN, CH3COONa тощо) і дає лужну реакцію середовища, це призводить до необоротності гідролізу обох солей, наприклад:
Al2(SO4)3+3K2CO3+3H2Oà2Al(OH)3¯ + 3CO2 + K2SO4,
2Al3+ + 3SO42– + 6K+ + 3CO32– + 3H2O à 2Al(OH)3¯ + 3CO2 + 6K+ + 3SO42–,
2Al3+ + 3CO32– + 3H2O à 2Al(OH)3¯ + 3CO2.
б) Na2SO3 – сіль, утворена катіоном сильної основи (NaOH) та аніоном слабкої кислоти (Н2SO3), гідроліз відбувається по аніону – переважно за першим ступенем. Внаслідок цього утворюється слабка кислота (гідросульфіт-аніон НSO3–) і накопичуються йони ОН–, які забезпечують лужну реакцію середовища,  .
.
Na2SO3 + H2O Û NaHSO3 + NaOH,
2Na+ + SO32– + H2O Û Na+ + HSO3– + Na+ + OH–,
SO32– + H2O Û HSO3– + OH–.
Посилити гідроліз Na2SO3 можна за допомогою таких заходів:
- розведення розчину при додаванні води, що призводить до зміщування гідролітичної рівноваги вправо;
- підвищення температури
- додавання невеликої кількості сильної кислоти, яка буде зв’язувати йони ОН–, зміщуючи гідролітичну рівновагу вправо;
- додавання розчину іншої солі, яка гідролізується за протилежним типом (тобто по катіону, наприклад, NH4Cl, ZnSO4, Cd(NO3)2, Cr(NO3)3) і дає кислотну реакцію середовища, що зумовлює перебіг сумісного необоротного гідролізу, наприклад:
2FeCl3 + 3Na2SO3 + 3H2O à 2Fe(OH)3¯ + 3SO2 + 6NaCl,
2Fe3+ + 3SO42– + 6Na+ + 3SO32– + 3H2O à 2Fe(OH)3¯ + 3SO2 + 6Na+ + 6Cl–,
2Fe3+ + 3SO32– + 3H2O à 2Fe(OH)3¯ + 3SO2.
в) 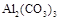 – сіль, утворена катіоном слабкої основи
– сіль, утворена катіоном слабкої основи  та аніоном слабкої кислоти
та аніоном слабкої кислоти  , тому гідролізується одночасно як по катіону, так і по аніону, причому одразу за всіма ступенями, повністю. Завдяки зв’язуванню йонів
, тому гідролізується одночасно як по катіону, так і по аніону, причому одразу за всіма ступенями, повністю. Завдяки зв’язуванню йонів  і
і  у недисоційовану сполуку H2O, а також утворенню осаду Al(OH)3 і газу CO2, гідроліз солі
у недисоційовану сполуку H2O, а також утворенню осаду Al(OH)3 і газу CO2, гідроліз солі  відбуваєтьсяь необоротно. Реакція середовища нейтральна,
відбуваєтьсяь необоротно. Реакція середовища нейтральна, 

|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 10202; Нарушение авторских прав?; Мы поможем в написании вашей работы!