
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вимірювання швидкості реакції
|
|
|
|
Лекція 2. Методи визначення швидкості та порядку реакції
Вимірювання швидкості реакції зводиться до експериментального визначення залежності концентрації реагуючих речовин від часу. У кожному конкретному випадку це завдання вирішується з допомогою певного хімічного чи фізичного методу кількісного аналізу.
Хімічні методи аналізу дають можливість безпосередньо визначити концентрацію одного з учасників реакції. Однак у цьому методі необхідно відносити аналітичні дані до фіксованого моменту часу – зупиняти реакцію шляхом певного впливу на неї: різке зниження температури, нейтралізація одного з реагентів або каталізатора, додавання інгібітору та ін.
Фізичні методи, хоча і не дають можливість визначити абсолютне значення концентрації реагентів, є більш зручними, оскільки дають можливість неперервного визначення якоїсь із властивостей реагуючих речовин, що пропорційна їх концентрації. Це може бути: вимірювання тиску при протіканні реакцій у газовому стані; вимірювання зміни об’єму реакційної суміші (дилатометричний метод); вимірювання в’язкості реакційної суміші; вивчення оптичних властивостей розчину: кута обертання поляризованого світла, показника заломлення, поглинання світла (колориметрія) у видимому, ІЧ та УФ спектрах. Застосовують також електричні методи аналізу: кондуктометрію, полярографію, потенціометрію, рН-метрію тощо. Перевагою фізичних методів є простота та висока швидкість проведення аналізу, можливість неперервної фіксації даних, інертність по відношенню до реакції. Одним з недоліків фізичних методів є нелінійна, у багатьох випадках, залежність між фізичною властивістю та концентрацією речовини, що вимагає проведення калібрувальних дослідів.
При визначення порядку реакції користуються:
– методом рівних концентрацій – концентрації реагентів в початковий момент часу однакові. Це дає можливість визначити загальний порядок реакції;
– методом надлишкових концентрацій – концентрації усіх речовин, крім однієї дуже великі і їх можна вважати незмінними під час перебігу реакції (метод ізоляції Оствальда). Цей метод використовують тоді, коли необхідно встановити порядок реакції за однією з реагуючих речовин (частковий порядок).
В залежності від мети дослідження, у кожному з цих способів можна скористуватись одним з інтегральних методів, або ж диференційним методом Нойеса-Оствальда.
Інтегральні методи визначення порядку реакції використовують інтегральні форми кінетичних рівнянь відповідних порядків. До них відносять: метод підстановки, графічний метод, метод визначення порядку за часом перетворення певної частки реагентів
Метод підстановки полягаєу тому, що кінетичні дані c=f(τ) по черзі підставляють у кінетичні рівняння (5,9,17,22) нульового, першого, другого та третього порядків та порівнюють отримані значення константи швидкості для різних значень часу τ. Якщо розрахована за якимось із цих рівнянь константа швидкості є незмінною у межах похибки експерименту, то вважають, що дане рівняння адекватно описує кінетичні дані і, відповідно, реакція є саме цього порядку.
Наприклад, в реакції N2O5 = N2O4 + 0,5O2 концентрація N2O5 наступним чином змінюваласьз часом:
Таблиця 1
| τ, с | |||||||||
| с,моль/л | 2,33 | 2,08 | 1,91 | 1,67 | 1,36 | 1,11 | 0,72 | 0,55 | 0,34 |
Розраховані за рівняннями (9,17,22) константи швидкості матимуть значення:
Таблиця 2
| τ, с | |||||||||
| k2*104, с-1моль - 1 м3 | - | 2,80 | 2,96 | 3,22 | 3,53 | 3,94 | 5,11 | 6,00 | 7,99 |
| k3*104, с-1моль -2 м 6 | - | 1,28 | 1,41 | 1,66 | 2,06 | 2,62 | 4,65 | 6,74 | 13,50 |
З наведених даних випливає, що дана реакція є першого порядку, бо розрахована за рівнянням першого порядку константа швидкості приблизно однакова, у той час, як за рівняннями другого та третього порядків – змінюється.
Графічний метод полягає у побудові кінетичних кривих у координатах першого  , другого
, другого  та третього
та третього  порядків. Отримана пряма свідчить про відповідність реакції даному порядку.
порядків. Отримана пряма свідчить про відповідність реакції даному порядку.
Застосуємо даний метод для наведеної вище реакції. За даними табл.1 розрахуємо дані для побудови графікі в і заносимо їх у табл. 3.
Таблиця 3
| τ, с | |||||||||
| ln с | 0,85 | 0,73 | 0,65 | 0,51 | 0,31 | 0,10 | -0,33 | -0,60 | -1,08 |
| 1/с, моль/л | 0,429 | 0,481 | 0,524 | 0,599 | 0,735 | 0,901 | 1,389 | 1,818 | 2,941 |
| 1/с2, (моль/л)2 | 0,184 | 0,231 | 0,274 | 0,359 | 0,541 | 0,812 | 1,929 | 3,306 | 8,651 |

Рис.9.Кінетичні дані в координатах першого порядку

Рис.10.Кінетичні дані в координатах другого порядку
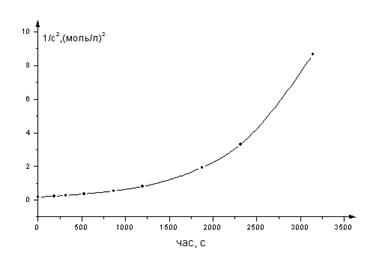
Рис.11.Кінетичні дані в координатах третього порядку
Приведені графіки показують, що лише в координатах першого порядку отримано пряму. Отже, дана реакція є реакцією першого порядку.
Метод визначення порядку реакції зачасом половинного перетворення. У цьому методі встановлюють залежність часу половинного перетворення від початкової концентрації  . Якщо час половинного перетворення не залежить від початкової концентрації – порядок реакції перший, якщо обернено пропорційний –другий, якщо обернено пропорційний до квадрату початкової концентрації –третій.
. Якщо час половинного перетворення не залежить від початкової концентрації – порядок реакції перший, якщо обернено пропорційний –другий, якщо обернено пропорційний до квадрату початкової концентрації –третій.
Метод Нойєса-Оствальда. В цьому методі використовують логарифмічну форму рівняння (25):
 (25)
(25)
або
 (26)
(26)
Логарифмуємо рівняння (26) і дістанемо:
 (27)
(27)
Запишемо (26) для двох початкових концентрацій:
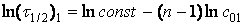 (а)
(а)
 (б)
(б)
Віднімемо (б) від(а) і дістанемо:
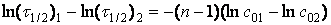 (в) звідки:
(в) звідки:
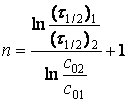 (28)
(28)
Даний метод має також графічну інтерпретацію. Рівняння (27) є рівнянням прямої в координатах  . Кутовий коефіцієнт даного рівняння
. Кутовий коефіцієнт даного рівняння  , а отже,
, а отже,  .
.

Рис.12. Визначення порядку реакції методомНойєса-Оствальда
У двох останніх методах можна використовувати не лише час половинного перетворення, а й час перетворення будь якої іншої часткиречовини – 1/3, 2/3, 1/4 тощо.
Диференційний метод Вант-Гоффа базується на використанні логарифмічної форми рівняння (4). Для початкового моменту часу:

Якщо підтримувати постійною початкову концентрацію усіх реагентів крім одного (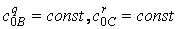 ) то дістанемо спрощене рівняння:
) то дістанемо спрощене рівняння:

або
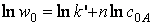 (29)
(29)
Запишемо данерівняння для двох початкових концентрацій:
 (а)
(а)
 (б)
(б)
Віднімемо (б) від (а) і дістанемо:
 , або:
, або:
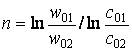 (30)
(30)
Для визначенняшвидкості реакції у початковий момент часу користуються методом дотичних, абометодом кінцевих різниць.
У методі дотичних будують початковіділянки кінетичних кривих 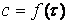 для різних значень
для різних значень  і за тангенсом кутанахилу дотичної до кривої у початковий момент часу знаходять
і за тангенсом кутанахилу дотичної до кривої у початковий момент часу знаходять  .
.
У методі кінцевих різниць використовуютьтой факт, що будь яку залежність у початковий момент часу можна описативідрізком прямої, а швидкість знаходять, як середню за невеликий проміжок часуΔτ:
 .
.
Диференційний метод Вант-Гоффа також має графічну інтерпретацію. Рівняння (29) є рівнянням прямої у координатах  . Кутовий коефіцієнт даної прямої
. Кутовий коефіцієнт даної прямої  .
.
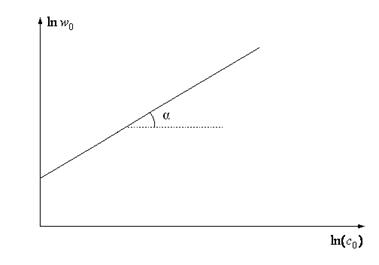
Рис.13. Визначення порядку реакції диференційним методом Вант-Гоффа
Таким чином для визначення порядку реакції необхідно мати хоча б одну повну кінетичну криву, або кілька початкових ділянок кінетичної кривої при різних початкових концентраціях.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1691; Нарушение авторских прав?; Мы поможем в написании вашей работы!