
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Производные азота
|
|
|
|
Окислы азота (NO и NO2) фигурируют среди естественных составляющих атмосферы. Но они также образуются в значительных количествах в процессе горения при высокой температуре и особенно в двигателях внутреннего сгорания.
Хотя закиси азота (N2O) в естественной атмосфере больше, чем других окислов азота (ее средняя концентрация составляет около 0.25 млн-1), она не играет существенной роли в загрязнении атмосферы.
двуоки сь азота (NO2) - стабильный газ желто-коричневого цвета, сильно ухудшающий видимость и в большинстве случаев придающий характерный коричневый оттенок воздуху в городах. Одной из физических особенностей этого газа является сильное поглощение УФ в области 0.3-0.4 мкм, под влиянием которого он разрушается согласно схеме:
NO2  NO + O*
NO + O*
Этот газ обуславливает так называемое фотохимическое загрязнение вследствие взаимодействия продуктов реакции с другими веществами, присутствующими в воздухе: SO2, О2, углеводороды. Некоторые получаемые в результате вещества фитотоксичны и очень опасны.
NO2 является результатом спонтанной побочной реакции с участием окиси азота:
2NO + O2 ® 2NO2
Эта реакция имеет тенденцию идти в обратном направлении при температуре > 6000С, что объясняет преобладание NO над NO2 в выхлопных газах.
В атмосфере при нормальной температуре требуется неделя для того, чтобы 9/10 NO с начальной концентрацией 10 млн-1 трансформировалось в NO2.
Масса NO2, ежегодно выбрасываемого в атмосферу в результате деятельности человека, оценивается в 53. 106 т, что составляет примерно 1/10 общей массы этого газа, образующегося при различных биогеохимических процессах. Естественными источниками производных азота являются анаэробные микроорганизмы, производящие NO, который затем окисляется в воздухе до NO2, а также вулканическая деятельность.
Попавшая в атмосферу различными путями перекись азота недолго находится в ней - в среднем около 3 суток. Она превращается при взаимодействии с водяным паром в азотную кислоту. Все нитраты, образовавшиеся вследствие реакций между HNO3 и различными катионами, присутствующими в воздухе, встречаются в атмосферных аэрозолях. Потом они возвращаются на землю с осадками, доставляя необходимые нитраты растениям.
Пероксилацилнитраты (ПАН)
Эти соединения образуются под влиянием сильной солнечной радиации в процессе фотохимической реакции между различными веществами, входящими в состав загрязненного воздуха.
Пероксилацилнитраты образуются согласно следующей основной реакции:

R может быть алифатическим, ароматическим или гетероциклическим радикалом.
При образовании смогов, содержащих ПАН, в серии фотохимических реакций участвуют окислы азота, озон и несгоревшие углеводороды, выброшенные в атмосферу двигателями внутреннего сгорания. Эти реакции являются наиболее сложными не только из-за разнообразия участвующих в них химических веществ, но и вследствие их сложного механизма. Наиболее характерной реакцией на первых этапах является промежуточное образование озона. Образовавшаяся из окиси азота фотохимическим окислением перекись азота может таким же путем диссоциировать:
NO2  NO + O*
NO + O*
Выделившийся атомарный кислород реагирует с молекулярным кислородом в присутствии металлических аэрозолей, исполняющих роль катализатора:
O* + О2 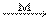 О3
О3
Следствием двух неорганических реакций является уравнение, характеризующее динамическое равновесие между NO2 и озоном:
NO2 + О2 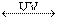 NO + O3
NO + O3
Максимум концентрации окислителей, вызывающих смог, наблюдается в полдень.
Атомарный кислород и озон реагируют с углеводородами и образуют ацилпероксиды R-O-O- и пероксилацилы R-C-O-O-.

Последние, взаимодействуя с перекисью азота, в свою очередь образуют ПАН. Следует отметить, что эти вещества были синтезированы в лаборатории при облучении смеси перекиси азота, озона и некоторых альдегидов ультрафиолетовой радиацией.
При концентрации в несколько десятых млн-1 ПАН могут вызвать сильное раздражение глаз и нанести серьезный ущерб растениям.
Озон (О3)
Озон - естественная составляющая атмосферы. Количество озона в атмосфере невелико (2х10-6 % по объему), но он играет важную роль в предохранении земной поверхности от солнечной радиации. Разрушение озонового слоя происходит в результате окисления озоном различных веществ. По некоторым данным разрушение озонового слоя на 50% повлечет за собой увеличение дозы УФ радиации в 10 раз.
Концентрация озона вблизи земли меняется в зависимости от интенсивности УФ радиации. Концентрация озона увеличивается с высотой и достигает максимума в стратосфере, в слое 18-35 км. В пустынях с высокой интенсивностью УФ радиации содержание озона оценивается в 15 млрд-1, а в горах на высоте 3000 м зафиксирована концентрация 150 млрд-1. В атмосфере городов, подверженных фотохимическому смогу, обнаружены концентрации озона свыше 1 млн-1. Столь высокое содержание этого газа вредно для животных и в еще большей степени - для растений.Образование озона в загрязненной атмосфере происходит в результате фотохимических превращений окислов азота.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 2018; Нарушение авторских прав?; Мы поможем в написании вашей работы!