
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 8. Многоэлектронные атомы
|
|
|
|
Почвы
Мобильный электротермический обеззараживатель
Из различных способов обеззараживания почвы наиболее эффективен электродный, при котором на вредителей и патогенные микроорганизмы растений, находящихся в почве, одновременно действуют два уничтожающих фактора: теплота и электрический ток.
Для растениеводства защищенного грунта разработан мобильный электротермический обеззараживатель почвы МЭОП-1, в котором в качестве рабочего органа использованы электроды в виде вращающихся дисков. Электрический ток, проходящий между заглубленными частями дисков, нагревает почву до температуры 80...90 °С. При этом в межэлектродной зоне в течение нескольких минут сохраняется теплота, пагубная для вредителей, микроорганизмов и грибковых культур. Наряду с термическим действием на фитопатогенные организмы гибельное действие оказывает и сам электрический ток, проходящий через почву.
При соответствующей влажности почвы и плотности тока гибель основных вредителей и возбудителей болезней растений наступает при температуре, меньшей на 20...30 °С, чем при паровом обеззараживании, а время процесса сокращается в 10...20 раз. Одновременно с этим увеличивается содержание подвижных элементов в почве, что способствует повышению ее плодородия.
Рабочие электроды машины, установленные в силовой части, размещены в специальной камере на изолированном валу, имеющем привод от электродвигателя через редуктор. От них вращается ходовое колесо. Управление машиной осуществляется тумблерами, размещенными на рукоятках управления. Для обеспечения заданной глубины обработки имеется опорная плита. Для поверхностной обработки установлен дополнительный инфракрасный нагреватель. С целью надежного прохождения электрического тока через переходный контакт между электродом и землей над каждым диском установлена капельница, куда подается вода из водораспределительного коллектора.
Перед обработкой почву рыхлят и доводят до влажности 40...50 %. Скорость движения машины, м/с,
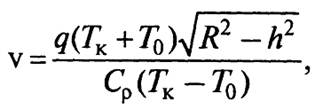
q —удельная мощность внутреннего объемного источника теплоты, Вт/м3; Tк, T0 — конечная и начальная температуры почвы, °С; R — радиус дискового электрода, м; h — глубина хода машины, м; Ср — объемная теплоемкость почвы, Дж/(м3 • °С).
Время экспозиции зависит от приложенного напряжения, расстояния между электродами, площади заглубленной части электродов, тока, коэффициента теплопроводности почвы и разности температур в начале и конце обработки.
Технические данные обеззараживателя МЭОП-1
Потребляемая мощность, кВт 30...50
Напряжение питания, В 380/220
Производительность, м2/ч 12... 14
Глубина обработки, мм 150...250
Ширина захвата, мм 500...700
Расход электроэнергии, кВт • ч/м2 4,2...5,6
Температура нагрева почвы, °С 80...90
Влажность подготовленной почвы, % 40
Напряженность поля, В/м 2600
Экспозиция нагрева, с Не более 120
Неравномерность нагрева межэлектродного объема 5...7
почвы, °С
Суммарный КПД установки 0,86
Масса, кг 150
Число обслуживающего персонала 1
Литература:
1. Е.Н. Живописцев, О.А. Косицын. Электротехнология и электрическое освещение. М.: Агропромиздат», 1990, с. 144-153.
2. Л.А. Баранов, В.А. Захаров. Электроосвещение и электротехнологии. М.: КолосС, 2006, с.233-234.
3. И.Ф.Кудрявцев, В.А. Карасев. Электрический нагрев и электротехнология. М.: Колос, 1975, с. 232-247.
Уровни энергии и спектры атомов щелочных металлов.
В атомах щелочных металлов 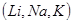 электронная оболочка содержит один наружный (валентный) электрон, сравнительно слабо связанный с ядром атома. Остальные
электронная оболочка содержит один наружный (валентный) электрон, сравнительно слабо связанный с ядром атома. Остальные  электронов образуют сравнительно прочный остов, в электрическом поле которого движется валентный электрон. В таком случае атом щелочного металла можно рассматривать как одноэлетронный атом, в котором роль заряда играет указанный остов, который можно характеризовать каким-то эффективным зарядом
электронов образуют сравнительно прочный остов, в электрическом поле которого движется валентный электрон. В таком случае атом щелочного металла можно рассматривать как одноэлетронный атом, в котором роль заряда играет указанный остов, который можно характеризовать каким-то эффективным зарядом  .
.
Потенциальную энергию валентного электрона можно представить в виде:
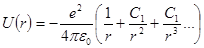 (8.1)
(8.1)
-где 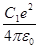 ,
, 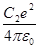 - поправки учитывающие отличие поля атомов щелочных металлов от поля атома водорода. Обычно в вычислениях ограничиваются первой поправкой.
- поправки учитывающие отличие поля атомов щелочных металлов от поля атома водорода. Обычно в вычислениях ограничиваются первой поправкой.
Подстановка (8.1) в уравнение Шредингера и его решение приводят к выражению для полной энергии электрона, которое отличается от аналогичного выражения для атома водорода слагаемым 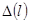 :
:
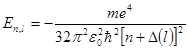 , (8.2)
, (8.2)
-где 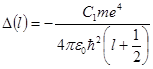 .
.
Таким образом, принципиальное отличие уровней энергии щелочных металлов от уровней энергии атома водорода состоит в том, что энергия теперь зависит не только от квантового числа 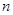 , но и от орбитального числа
, но и от орбитального числа 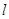 .
.
Другими совами, в некулоновском центрально-симметричном поле вырождение по 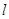 снимается.
снимается.
С учетом правил отбора 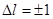 в спектрах щелочных металлов должны получаться следующие спектральные серии:
в спектрах щелочных металлов должны получаться следующие спектральные серии:
главная серия 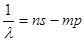 ;
; 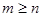
диффузная серия 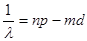 ;
; 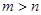
резкая серия 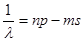 ;
; 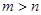
фундаментальная серия 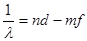 ;
; 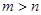 .
.
Главная серия возникает в результате квантовых переходов валентного электрона из различных 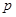 -состояний на наиболее глубокий
-состояний на наиболее глубокий 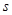 - уровень. Главная серия содержит наиболее характерную для рассматриваемого элемента резонансную линию
- уровень. Главная серия содержит наиболее характерную для рассматриваемого элемента резонансную линию
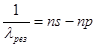 .
.
Таковы, например, красная линия лития и желтая линия натрия.
Диффузная серия возникает в результате переходов валентного электрона из различных 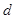 - состояний на наиболее глубокий
- состояний на наиболее глубокий 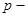 уровень, резкая серия – из различных
уровень, резкая серия – из различных 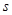 - состояний на более глубокий
- состояний на более глубокий 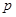 - уровень.
- уровень.
Рассмотрим тонкую структуру уровней и спектральных линий щелочных металлов, закономерности которых являются более простыми, чем для атома водорода, у которого существует вырождение по 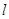 .
.
Происхождение тонкой структуры в спектральных сериях натрия представлено на рис. 8.1.
Рис. 8.1.
Главная серия возникает в результате переходов на наиболее глубокий уровень 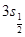 с вышележащих
с вышележащих 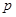 - уровней. Уровень
- уровней. Уровень 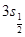 -простой, а все
-простой, а все 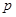 -уровни двойные, причем расстояние между компонентами этих уровней, а значит и между компонентами дуплета, убывает с возрастанием
-уровни двойные, причем расстояние между компонентами этих уровней, а значит и между компонентами дуплета, убывает с возрастанием 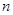 . Поэтому и сами спектральные линии главной серии получаются двойными – дуплетами. Наиболее интенсивной является желтая резонансная линия натрия, возникающая при переходах
. Поэтому и сами спектральные линии главной серии получаются двойными – дуплетами. Наиболее интенсивной является желтая резонансная линия натрия, возникающая при переходах 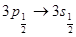 и
и 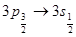 .
.
Линии резкой серии также являются дуплетами, они возникают в результате переходов с простых 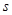 - уровней на лежащий ниже двойной
- уровней на лежащий ниже двойной 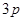 - уровень. Поэтому расстояния между компонентами дуплетов одни и те же для всех серий, так как обуславливаются расщеплением одного и того же уровня
- уровень. Поэтому расстояния между компонентами дуплетов одни и те же для всех серий, так как обуславливаются расщеплением одного и того же уровня 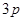 , причем сами компоненты являются резкими линиями. По этой причине и сама серия получила название резкой.
, причем сами компоненты являются резкими линиями. По этой причине и сама серия получила название резкой.
Диффузная серия возникает при переходах на двойной уровень 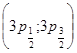 с вышележащих также двойных уровней
с вышележащих также двойных уровней 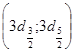 ,
, 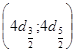 и т. д. Ее спектральные линии являются триплетами, так как переходы типа
и т. д. Ее спектральные линии являются триплетами, так как переходы типа 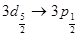 ;
; 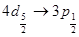 , в которых число
, в которых число 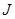 меняется на 2, запрещены правилами отбора.
меняется на 2, запрещены правилами отбора.
Две линии, получающиеся при переходе с двух расщепленных уровней 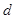 на один и тот же уровень
на один и тот же уровень 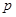 , расположены весьма близко друг к другу и практически сливаются. Благодаря этому они воспринимаются как одна размытая линия. Расщепление же между парой линий и одиночной линией значительно. Поэтому, в целом все эти три линии воспринимаются как дуплет из размытых линий, а вся серия названа диффузной. Расщепление дуплета у всех линий серии одно и то же, поскольку оно определяется расщеплением одного и того же уровня
, расположены весьма близко друг к другу и практически сливаются. Благодаря этому они воспринимаются как одна размытая линия. Расщепление же между парой линий и одиночной линией значительно. Поэтому, в целом все эти три линии воспринимаются как дуплет из размытых линий, а вся серия названа диффузной. Расщепление дуплета у всех линий серии одно и то же, поскольку оно определяется расщеплением одного и того же уровня 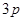 .
.
2. Понятие об электронной конфигурации. Применение принципа Паули. Электронные оболочки атома и их заполнение. Физическое объяснение физического закона.
В обычных условиях атомы всех элементов находятся в нормальном состоянии, когда энергия их электронов минимальна. В связи с этим можно было бы ожидать, что в нормальном состоянии все электроны должны находится на наинизшем энергетическом уровне с 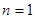 . Однако независимо от номера оболочки на ней может находиться не любое количество электронов, а только определенное.
. Однако независимо от номера оболочки на ней может находиться не любое количество электронов, а только определенное.
Заполнение оболочек в многоэлектронных атомах подчиняется принципам Паули и минимальной энергии. При конкретном количестве электронов атома, прежде всего ими заполняются свободные оболочки, характеризующиеся минимальной энергией в соответствии с принципом Паули, согласно которому в любом атоме в конкретном квантовом состоянии, характеризуемом четырьмя квантовыми числами 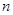 ,
, 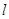 ,
, 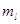 ,
, 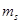 не может быть более одного электрона. Следовательно, максимальное количество электронов
не может быть более одного электрона. Следовательно, максимальное количество электронов 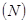 , образующих устойчивую электронную оболочку с главным квантовым числом определяется как
, образующих устойчивую электронную оболочку с главным квантовым числом определяется как 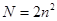 .
.
Таким образом, совокупность электронов, обладающих одним и тем же квантовым числом, называется оболочкой. Для обозначения оболочек используют прописные буквы:
| Главное квантовое число n | |||||
| Обозначение оболочек | K | L | M | N | O |
Максимальное число
Электронов в оболочке 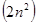
|
Состояния орбитального движения электронов характеризуются орбитальным квантовым числом 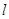 и обозначаются строчными буквами.
и обозначаются строчными буквами.
| Орбитальное квантовое число l | |||||
| Орбитальное состояние | s | p | d | f | g |
Максимальное число
электронов 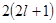
|
Рассмотрим заполнение оболочек электронов в периодической системе Менделеева.
В основе систематики химических элементов лежит заряд Z. Число Z и определяет порядковый номер элемента в таблице. Заряд ядра численно равен числу электронов в электронной оболочке, окружающей ядро нейтрального атома. Химические свойства элементов определяются наружными электронами электронной оболочки.
В естественном состоянии в природе встречаются 90 элементов. Наибольший атомный номер (92) имеет уран. Элементы 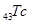 (технеций) и
(технеций) и 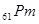 (прометий) в естественных состояниях не встречаются. Элементы с атомным номером больше 92 называются трансурановыми. Они все радиоактивны и также получены искусственно. К настоящему времени получены элементы с порядковыми номерами до 109 включительно.
(прометий) в естественных состояниях не встречаются. Элементы с атомным номером больше 92 называются трансурановыми. Они все радиоактивны и также получены искусственно. К настоящему времени получены элементы с порядковыми номерами до 109 включительно.
Посмотрим, как меняются электронные конфигурации при переходе от одного атома к другому в порядке возрастания их атомных номеров Z. То есть при присоединении одного электрона.
Идеальная схема заполнения строится по принципу: каждый вновь присоединившийся электрон при заданном n последовательно заполняет все оболочки от 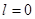 до
до 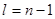 , после этого переходит к заполнению оболочек, соответствующих главному квантовому числу
, после этого переходит к заполнению оболочек, соответствующих главному квантовому числу 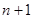 .
.
Последовательность заполнения электронных состояний при одном и том же 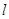 определяется правилом Хунда:
определяется правилом Хунда:
Сначала заполняются состояния с различными значениями квантового числа 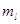
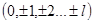 при одинаковом значении проекции спина (например, при
при одинаковом значении проекции спина (например, при 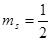 ); после того, как все
); после того, как все 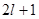 состояний по квантовому числу
состояний по квантовому числу 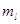 оказываются заполненными электронами с одинаковой проекцией спина, начинается их заполнение электронами с противоположной проекцией спина (три
оказываются заполненными электронами с одинаковой проекцией спина, начинается их заполнение электронами с противоположной проекцией спина (три 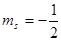 ).
).
Открывает таблицу Менделеева водород, который имеет один электрон, который находится в состоянии с минимальной энергией, то есть при 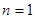 ,
, 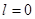 ; поэтому электронная конфигурация этого атома
; поэтому электронная конфигурация этого атома 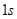 . У гелия Не добавляется еще один электрон, но с противоположным направлением спина. Поэтому электронная конфигурация гелия записывается
. У гелия Не добавляется еще один электрон, но с противоположным направлением спина. Поэтому электронная конфигурация гелия записывается 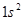 .
.
Гелий является инертным газом (имеет полностью заполненную внешнюю оболочку) и закрывает первый период периодической системы.
Третьим элементом является 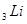 , у которого три электрона и по принципу Паули третий электрон не может находиться в состоянии
, у которого три электрона и по принципу Паули третий электрон не может находиться в состоянии 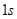 . Поэтому он размещается на оболочке с
. Поэтому он размещается на оболочке с 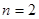 и
и 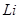 открывает второй период таблицы. Его электронная конфигурация
открывает второй период таблицы. Его электронная конфигурация 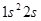 . Затем идет
. Затем идет 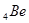 с конфигурацией
с конфигурацией 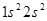 и
и 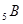 -
-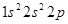 . В
. В 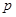 -состоянии может находиться шесть электронов. Шесть элементов от бора до неона включительно образуются в результате заполнения
-состоянии может находиться шесть электронов. Шесть элементов от бора до неона включительно образуются в результате заполнения 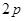 - состояний.
- состояний.
На неоне (также инертном газе, потому что внешняя оболочка заполнена полностью - 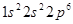 ) завершается построение второго периода.
) завершается построение второго периода.
Появление одиннадцатого электрона приводит к необходимости заполнения оболочки с 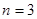 , поэтому
, поэтому 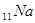 открывает третий период таблицы. Его электронная конфигурация
открывает третий период таблицы. Его электронная конфигурация 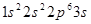 . Наличие у натрия вне заполненной оболочки одного электрона (валентного), обуславливает сходство его физико-химических свойств со свойствами
. Наличие у натрия вне заполненной оболочки одного электрона (валентного), обуславливает сходство его физико-химических свойств со свойствами 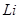 , который открывает второй период. Оба эти элемента обладают металлическими свойствами и относятся к щелочным металлам. Восемь элементов от натрия
, который открывает второй период. Оба эти элемента обладают металлическими свойствами и относятся к щелочным металлам. Восемь элементов от натрия 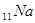 до
до 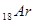 получаются вследствие заполнения состояний
получаются вследствие заполнения состояний 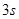 и
и 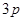 . Таким образом третий период также заканчивается инертным газом с электронной конфигурацией
. Таким образом третий период также заканчивается инертным газом с электронной конфигурацией 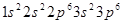
 . Следующим элементом после
. Следующим элементом после 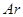 является
является 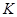 . С этого места появляются нарушения идеального порядка заполнения оболочек. По идеальной схеме его конфигурация
. С этого места появляются нарушения идеального порядка заполнения оболочек. По идеальной схеме его конфигурация 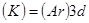 . Но в действительности это не так. Энергетически более выгодным оказывается присоединение следующего электрона не в состояние
. Но в действительности это не так. Энергетически более выгодным оказывается присоединение следующего электрона не в состояние 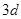 , а в состояние
, а в состояние 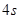 . Таким образом, с калия начинается четвертый период таблицы Менделеева. Конфигурация следующего после калия элемента
. Таким образом, с калия начинается четвертый период таблицы Менделеева. Конфигурация следующего после калия элемента 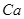 есть
есть 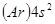 . После этого энергетически более выгодным оказывается заполнение
. После этого энергетически более выгодным оказывается заполнение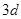 - состояний, а не
- состояний, а не 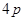 - состояний, идущих по порядку после
- состояний, идущих по порядку после 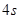 - состояний. У последующих элементов до никеля происходит заполнение
- состояний. У последующих элементов до никеля происходит заполнение 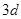 - состояний, при этом оболочка
- состояний, при этом оболочка 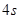 не остается все время заполненной двумя электронами. Иногда оказывается энергетически более выгодным перебросит один из электронов из
не остается все время заполненной двумя электронами. Иногда оказывается энергетически более выгодным перебросит один из электронов из 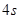 в
в 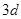 - оболочку. Такой переброс наблюдается у хрома:
- оболочку. Такой переброс наблюдается у хрома: 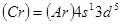 .
.
Нарушение идеального порядка заполнения объясняется наличием у электронов орбитальных моментов количества движения: 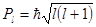 . При орбитальном вращении электрона вокруг ядра появляется центробежная сила, которая стремится удалить электрон от ядра. Таким образом, центробежная
. При орбитальном вращении электрона вокруг ядра появляется центробежная сила, которая стремится удалить электрон от ядра. Таким образом, центробежная  и электрическая энергии имеют противоположные знаки и поэтому действуют в разные стороны, в результате чего электроны
и электрическая энергии имеют противоположные знаки и поэтому действуют в разные стороны, в результате чего электроны 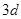 - оболочки
- оболочки 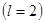 обладают меньшей энергией связи, чем электроны
обладают меньшей энергией связи, чем электроны 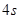 - оболочки
- оболочки 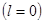 . Поэтому-то оболочка
. Поэтому-то оболочка 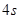 заполняется электронами раньше, чем оболочка
заполняется электронами раньше, чем оболочка 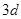 , хотя главное квантовое число во втором случае меньше, чем в первом. Особенно велика,,центробежная энергия” в случае
, хотя главное квантовое число во втором случае меньше, чем в первом. Особенно велика,,центробежная энергия” в случае 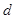 - и
- и 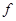 - оболочек, поскольку для этих оболочек соответственно
- оболочек, поскольку для этих оболочек соответственно 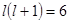 и
и 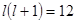 . С наличием этих оболочек и связаны отступления от идеального порядка.
. С наличием этих оболочек и связаны отступления от идеального порядка.
Поэтому в действительности энергетическое возрастание электронных уровней с увеличением номера оболочек определяется следующим рядом:
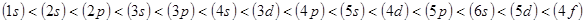 .
.
Электронная конфигурация 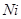 имеет вид:
имеет вид: 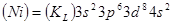 , причем символ
, причем символ 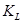 означает полностью заполненные
означает полностью заполненные 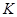 и
и 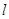 - оболочки. Поэтому у никеля для полного заполнения м – оболочки не хватает два электрона, так как максимальное число электронов в
- оболочки. Поэтому у никеля для полного заполнения м – оболочки не хватает два электрона, так как максимальное число электронов в 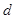 - состоянии – 10.
- состоянии – 10.
Элементы, которые имеют недостроенные внутренние электронные оболочки, называют переходными. В четвертом периоде такими элементами являются элементы с №21 (скандий) по №28 (никель). Однако обычно к переходным элементам относят только последние три: Fe, Co, Ni, то есть те элементы, у которых оболочка недостроена меньше чем наполовину. Ni завершает первый полупериод четвертого периода. У следующего за никелем элемента меди Cu добавляется один электрон, при этом энергетически более выгодным является перераспределение электронов, в результате которого 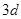 - состояние оказывается полностью заполненным, а в
- состояние оказывается полностью заполненным, а в 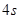 - состоянии остается лишь один электрон, и конфигурация меди имеет вид:
- состоянии остается лишь один электрон, и конфигурация меди имеет вид: 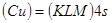 , то есть ее конфигурация аналогична конфигурации щелочных металлов. У последующих семи элементов продолжается заполнение N – оболочки (
, то есть ее конфигурация аналогична конфигурации щелочных металлов. У последующих семи элементов продолжается заполнение N – оболочки (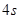 и
и 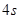 - состояний), то ест конфигурации внешних электронов повторяют конфигурации 2-го и 3-го периода. У криптона
- состояний), то ест конфигурации внешних электронов повторяют конфигурации 2-го и 3-го периода. У криптона 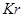 завершается заполнение
завершается заполнение 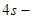 и
и 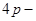 состояний, в результате чего криптон является инертным газом. На криптоне завершается первый большой период периодической системы, состоящий из 18 элементов. (по сути четвертый период).
состояний, в результате чего криптон является инертным газом. На криптоне завершается первый большой период периодической системы, состоящий из 18 элементов. (по сути четвертый период).
Затем повторяется четвертый период. У рубидия 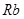 , идущего после криптона, начинается заполнение
, идущего после криптона, начинается заполнение 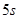 - состояния, поскольку это оказывается энергетически более выгодно, чем заполнение
- состояния, поскольку это оказывается энергетически более выгодно, чем заполнение 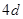 и
и 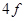 - состояний. После заполнения
- состояний. После заполнения 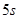 - состояния у стронция, следующего за рубидием, заполнение
- состояния у стронция, следующего за рубидием, заполнение 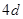 - состояний, вследствие чего элементы с№39 (иттрия) по №46 (палладий) относятся к переходным, особенно это относится к рутению, родию и палладию, который заканчивает первый полупериод пятого периода.
- состояний, вследствие чего элементы с№39 (иттрия) по №46 (палладий) относятся к переходным, особенно это относится к рутению, родию и палладию, который заканчивает первый полупериод пятого периода.
Выполнение второго полупериода пятого периода полностью аналогично второму полупериоду четвертого периода, то есть у первых двух элементов заполняется 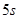 - оболочка, у следующих шести -
- оболочка, у следующих шести - 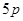 - оболочка. Таким образом, второй большой период также заканчивается инертным газом
- оболочка. Таким образом, второй большой период также заканчивается инертным газом 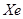 - ксеноном, у которого полностью заполнена
- ксеноном, у которого полностью заполнена 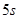 - и
- и 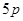 - оболочка.
- оболочка.
У цезия 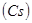 и бария
и бария 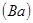 , которые открывают четвертый период таблицы, заполняется
, которые открывают четвертый период таблицы, заполняется 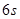 - состояние. Затем у лантана дополнительный электрон добавляется на внутреннюю оболочку в
- состояние. Затем у лантана дополнительный электрон добавляется на внутреннюю оболочку в 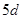 - состоянии, а у следующих за ним 14 элементов заполняются
- состоянии, а у следующих за ним 14 элементов заполняются 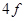 - состояния. Поскольку электроны в
- состояния. Поскольку электроны в 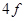 - состоянии являются внутренними (более внешние оболочки уже заполнены), это заполнение
- состоянии являются внутренними (более внешние оболочки уже заполнены), это заполнение 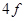 - состояния существенно не изменяет химических свойств элементов. Поэтому все эти 14 элементов в периодической системе занимают одну клетку, и называются лантаноидами или редкоземельными элементами. У следующих семи элементов (от гафния до платины) идет заполнение
- состояния существенно не изменяет химических свойств элементов. Поэтому все эти 14 элементов в периодической системе занимают одну клетку, и называются лантаноидами или редкоземельными элементами. У следующих семи элементов (от гафния до платины) идет заполнение 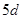 - оболочки, поэтому они, особенно последние три (осмий, иридий и платина) принадлежат к переходным элементам.
- оболочки, поэтому они, особенно последние три (осмий, иридий и платина) принадлежат к переходным элементам.
Второй полупериод четвертого периода начинается щелочным металлом 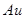 с одним внешним электроном в
с одним внешним электроном в 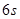 - состоянии, после заполнения которого в атоме ртути начинается заполнение
- состоянии, после заполнения которого в атоме ртути начинается заполнение 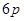 состояний, и заканчивается инертным газом радоном, у которого полностью заполнены
состояний, и заканчивается инертным газом радоном, у которого полностью заполнены 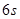 и
и 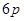 - состояния.
- состояния.
Седьмой период открывают франций и радий заполнением 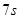 - оболочкой, далее следует актиний, у которого следующий электрон находится в состоянии
- оболочкой, далее следует актиний, у которого следующий электрон находится в состоянии 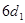 . Однако, у следующих 14 элементов после актиния происходит заполнение более внутренней оболочки
. Однако, у следующих 14 элементов после актиния происходит заполнение более внутренней оболочки 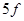 . Поэтому, они так же, как и лантаноиды, обладают схожими физико-химическими свойствами и называются актиноидами. У элементов, которые следуют за актиноидами, возобновляются заполнения
. Поэтому, они так же, как и лантаноиды, обладают схожими физико-химическими свойствами и называются актиноидами. У элементов, которые следуют за актиноидами, возобновляются заполнения 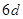 - оболочки.
- оболочки.
Периодическая система Менделеева обрывается на элементе 109, искусственно полученному к настоящему времени. Это, конечно, не означает, что в дальнейшем не могут быть получены элементы с большими атомными номерами. Из актиноидов только торий, протактиний и Уран существуют устойчиво в природе, остальные были получены лишь искусственно в лабораториях. Эти элементы называются трансурановыми. Таким образом, последним стабильным элементом в периодической системе, который существует в природе, является уран. Более тяжелые элементы существовать устойчиво не могут. Это объясняется тем, что силы кулоновского отталкивания протонов в ядре (которые являются дальнодействующими) не могут быть уравновешенными ядерными силами притяжения (которые являются короткодействующими, их действие проявляется на расстояниях 10-17 м) и ядро оказывается неустойчивым.
При малом числе частиц (нуклонов) в ядре энергия ядерного взаимодействия значительно больше энергии кулоновского отталкивания, потому что ядерные силы значительно больше кулоновских. Но при увеличении числа частиц наступает такой момент, когда ядерные силы притяжения уже не в состоянии хотя бы уравновесить кулоновские силы отталкивания, и ядро становится нестабильным. Этим и обуславливается наличие конца периодической системы элементов.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 517; Нарушение авторских прав?; Мы поможем в написании вашей работы!