
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Атом гелия
|
|
|
|
Простейшим после атома водорода является атом гелия, электронная оболочка которого состоит из двух электронов. Однако, несмотря на относительную простоту атома гелия, попытки построить его теорию в рамках старой теории Бора не увенчались успехом. В дальнейшем стало ясно, что старая теория Бора в принципе не могла дать решение проблемы атома гелия. Это обусловлено двумя обстоятельствами. Во-первых, теория Бора не позволяет учесть обменной энергии, существование которой является чисто квантовым эффектом. Во-вторых, теория Бора не учитывает наличие спина у электрона.
Теория многоэлектронных атомов в квантовой механике не встречает принципиальных трудностей, хотя практические вычисления весьма сложны и громоздки. В простейшем случае атома гелия, если не учитывать спины, задача сводится к решению уравнения Шредингера с двумя электронами. Полная энергия системы слагается из следующих частиц:
а) кинетических энергий обоих электронов;
б) потенциальных энергий обоих электронов в одном и том же поле ядра атома;
в) энергии взаимодействия между электронами:  .
.
Волновая функция  при этом зависит от координат обоих электронов, то есть шести переменных.
при этом зависит от координат обоих электронов, то есть шести переменных.
Таким образом, получаем следующее уравнение Шредингера для определения волновой функции  :
:
 (8.2)
(8.2)
Через  ,
, обозначены радиусы-векторы первого и второго электронов. Ядро атома в рассматриваемом приближении считается неподвижным и принимается за начало координат. Точное решение этого уравнения- очень сложная задача.
обозначены радиусы-векторы первого и второго электронов. Ядро атома в рассматриваемом приближении считается неподвижным и принимается за начало координат. Точное решение этого уравнения- очень сложная задача.
Такая задача решается с помощью теории возмущений, Которая использует тот факт, что энергия взаимодействия каждого из электронов с ядром больше, чем энергия взаимодействия электронов друг с другом. Поэтому в нулевом приближении можно пренебречь энергией взаимодействия.
Поскольку взаимодействие между электронами не учитывается, каждый из электронов считается движущимся в поле ядра совершенно не зависимо от движения другого электрона. Значит энергия двух электронов равна сумме энергий электронов:
 (8.3)
(8.3)
-где  - энергия первого электрона, находящегося в состоянии
- энергия первого электрона, находящегося в состоянии  ,
,  - энергия второго электрона находящегося в состоянии
- энергия второго электрона находящегося в состоянии  .
.
Учитывая, что функция 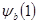 независима от
независима от  , получаем два уравнения:
, получаем два уравнения:

 (8.4)
(8.4)
Это есть уравнение движения электрона в кулоновском поле ядра. Решение этих уравнений, а значит и энергетические уровни каждого из электронов совпадают с энергетическими уровнями водородоподобного атома.
Однако такая сравнительно простая картина существенно изменяется, если принять во внимание взаимодействия электронов и их спины.
Волновая функция
 (8.5)
(8.5)
представляет решение уравнения Шредингера (8.2) с собственным значением энергии  . Очевидно, что из-за идентичности электронов ничего не изменится, если электрон 2 поместить в состояние
. Очевидно, что из-за идентичности электронов ничего не изменится, если электрон 2 поместить в состояние  , а электрон 1- в состояние
, а электрон 1- в состояние  . Таким образом, наряду с функцией (8.5) решением уравнения (8.2), также будет функция
. Таким образом, наряду с функцией (8.5) решением уравнения (8.2), также будет функция
 (8.6)
(8.6)
принадлежащая тому же собственному значению  , то есть имеются две волновые функции, принадлежащие одному и тому же собственному значению. Другими словами собственное значение энергии вырождено, что является результатом тождественности электронов. Такое вырождение называется обменным.
, то есть имеются две волновые функции, принадлежащие одному и тому же собственному значению. Другими словами собственное значение энергии вырождено, что является результатом тождественности электронов. Такое вырождение называется обменным.
Из-за идентичности электронов и возможности их обмена между состояниями  и
и  . Благодаря чему каждый из электронов как бы находится частично в состоянии
. Благодаря чему каждый из электронов как бы находится частично в состоянии  и частично в состоянии
и частично в состоянии  . Между ними возникает дополнительное взаимодействие, которое называется обменным. А соответствующая энергия – обменной энергией.
. Между ними возникает дополнительное взаимодействие, которое называется обменным. А соответствующая энергия – обменной энергией.
Обменная энергия не имеет классического аналога и является чисто квантовым эффектом.
Таким образом, полная энергия атома 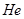 с учетом взаимодействия частиц будет выглядеть
с учетом взаимодействия частиц будет выглядеть
 (8.7)
(8.7)
-где С – член, характеризующий кулоновскую энергию взаимодействия
электронов
А – член, характеризующий обменную энергию взаимодействия, знак
которой определяется ориентировкой спинов.
Здесь возможны два варианта:

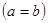 (8.8)
(8.8)


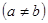 (8.9)
(8.9)
Первое уравнение соответствует случаю, когда оба электрона находятся в основном состоянии  , их полная энергия равна
, их полная энергия равна 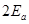 . Согласно принципу Паули, в этом случае они должны обладать противоположно направленными спинами. Тогда суммарное спиновое число
. Согласно принципу Паули, в этом случае они должны обладать противоположно направленными спинами. Тогда суммарное спиновое число  . Такой энергетический уровень есть синглетным, а гелий, который находится в таком квантовом состоянии, называется парагелием. Это электронная конфигурация
. Такой энергетический уровень есть синглетным, а гелий, который находится в таком квантовом состоянии, называется парагелием. Это электронная конфигурация 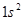 .
.
Благодаря взаимодействию электронов синглетный уровень сдвигается на величину, равную кулоновской энергии взаимодействия.

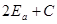

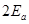
пусть теперь один из электронов находится в основном состоянии  , а второй электрон – в возбужденном состоянии
, а второй электрон – в возбужденном состоянии  . Тогда без учета взаимодействия полная энергия есть
. Тогда без учета взаимодействия полная энергия есть  . Этот энергетический уровень вырожден благодаря наличию обменного выражения: имеются синглетное
. Этот энергетический уровень вырожден благодаря наличию обменного выражения: имеются синглетное  и триплетное
и триплетное  состояние двух электронов с одной и той же энергией. Однако при учете взаимодействия электронов обменное выражение снимается – триплетное состояние (характеризуется отрицательной обменной энергией) имеет меньшую энергию, чем синглетное (характеризуется положительной энергией)
состояние двух электронов с одной и той же энергией. Однако при учете взаимодействия электронов обменное выражение снимается – триплетное состояние (характеризуется отрицательной обменной энергией) имеет меньшую энергию, чем синглетное (характеризуется положительной энергией)
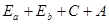


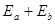


Гелий, находящийся в таком квантовом состоянии, называется ортогелием, (то есть такой, у которого спин второго электрона совпадает по направлению со спином первого). Ближайшее по энергии допустимое принципом Паули состояние второго электрона есть  . Таким образом, электронная конфигурация ортогелия -
. Таким образом, электронная конфигурация ортогелия -  .
.
Многоэлектронные атомы. Метод самосогласованного поля.
Метод теории возмущений подходит лишь к атомам с небольшим количествам электронов. При увеличении числа электронов используют метод Хартри, который основан на замене электрического поля ядра и всех электронов, кроме одного выделенного, некоторым самосогласованным полем, в котором движется один электрон.
Исходными здесь являются волновые функции отдельных электронов без взаимодействия. С их помощью вычисляется потенциал, действующий на отдельные электроны. С этим потенциалом, как известным. Решается уравнение Шредингера для каждого электрона, и находятся новые волновые функции. С их помощью определяется уточненный потенциал и затем с этим потенциалом для каждого электрона решается уравнение Шредингера, и находятся следующие волновые функции. По мере приближения к точному решению различия между исходными и конечными функциями на каждом этапе сглаживаются. Согласование состоит в том, что с одной стороны, волновые функции отдельных электронов формируются согласованным полем; с другой стороны, самосогласованное поле само зависит от вида волновых функций электронов.
Векторная модель атома.
В атоме с двумя и более электронами орбитальные и спиновые моменты всех его электронов могут складываться двумя способами. Первый способ осуществляется, когда взаимодействие орбитальных моментов  и
и  электронов и спиновых моментов
электронов и спиновых моментов  и
и  друг с другом сильнее, чем взаимодействие
друг с другом сильнее, чем взаимодействие  и
и  . Связь орбитального и спинового момента в этом случае называется слабой
. Связь орбитального и спинового момента в этом случае называется слабой  связью. Она является наиболее распространенной в легких атомах. Векторы орбитального и спинового моментов электронов складываются в этом случае порознь, образуя вектор суммарного орбитального момента атома:
связью. Она является наиболее распространенной в легких атомах. Векторы орбитального и спинового моментов электронов складываются в этом случае порознь, образуя вектор суммарного орбитального момента атома:
 ;
; 
и вектор суммарного спинового момента атома
 ;
;  .
.
Оба суммарных момента складываются в суммарный полный момент атома:
 ;
;  .
.
Ввиду различной возможной ориентации векторов  и
и  квантовое число
квантовое число 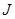 принимает следующие значения:
принимает следующие значения:  ,
,  , …
, … 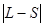 .
.
Второй способ сложения орбитальных и спиновых моментов атомных электронов осуществляется, когда взаимодействие  и
и  для каждого из электронов сильнее, чем взаимодействие порознь орбитальных и спиновых моментов различных электронов между собой. Связь моментов атомных электронов в этом случае называется сильной
для каждого из электронов сильнее, чем взаимодействие порознь орбитальных и спиновых моментов различных электронов между собой. Связь моментов атомных электронов в этом случае называется сильной  связью. Эта связь существует преимущественно в тяжелых атомах. Векторы орбитального и спинового моментов каждого электрона атома складываются, давая вектор полного момента электрона:
связью. Эта связь существует преимущественно в тяжелых атомах. Векторы орбитального и спинового моментов каждого электрона атома складываются, давая вектор полного момента электрона:  .
.
Суммарный полный момент атома образуется сложением полных моментов каждого из электронов
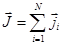 ;
;  .
.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 2713; Нарушение авторских прав?; Мы поможем в написании вашей работы!