
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Бор. Оксид бора, борные кислоты и их соли
|
|
|
|
Общая характеристика элементов III группы главной подгруппы периодической системы Д. И. Менделеева
Лекция № 13
Тема «Общая характеристика элементов III группы главной подгруппы»
План:
1) Общая характеристика элементов IIIА группы периодической системы
Д. И. Менделеева.
2) Бор. Оксид бора, борные кислоты и их соли.
3) Алюминий. Соединения алюминия. Амфотерный характер свойств оксида алюминия и гидроксида алюминия.
В главную подгруппу III группы входят элементы бор B, алюминий Al, галлий Ga, индий In, таллий Tl.
Бор относится к неметаллам, алюминий, галлий и индий – металлы, которые образуют оксиды и гидроксиды как основного, так и кислотного характера (амфотерные свойства).
На внешнем электронном слое атомы этих элементов содержат три электрона. Строение внешнего электронного слоя …. ns2 np1, р – элементы.
Все элементы подгруппы проявляют высшую степень окисления +3
В реакциях атомы этих элементов являются восстановителями, за исключением неметалла бора, который может быть и окислителем.
Сверху вниз по подгруппе
- радиусы увеличиваются,
- энергия ионизации уменьшается,
- металлические свойства усиливаются,
- неметаллические ослабевают,
- способность отдавать электроны увеличивается (восстановительная способность усиливается),
- основные свойства оксидов и гидроксидов усиливаются, а кислотные ослабевают
Бор открыт в 1808 г. Два выдающихся французских исследователя Гей-Люссак и Луи Тенар «отняли» воду у борной кислоты и на полученный оксид подействовали металлическим калием. Новое вещество совсем не походило на исходные вещества. Исследователи объявили об открытии нового элемента. В 1815г. В.М. Севергин ввел в номенклатуру название «бор».
Электронная конфигурация бора - 1s2 2s2 2p1
При нормальном состоянии бор должен проявлять валентность I (т.к. на внешнем уровне находится один неспаренный электрон), однако соединения, где бор проявляет степень окисления + 1, не устойчивы. При возбуждении один из электронов переходит на свободную р – орбиталь, т.е. на внешней
оболочке электроны становятся неспаренными. Такое состояние отвечает валентности – III, а в соединениях проявляется степень окисления +3.
Нахождение в природе
Бор принадлежит к числу распространенных элементов: содержание его в земной коре составляет приблизительно 5. 10-4% от общего числа атомов коры. Бор встречается в природе в основном в виде борной кислоты H3BO3 и солей ее полимерных форм: борокальцит СаB4O7 . 4H2O, борацит 2Mg3B8O15. МgСl2.и др.
Получение
Восстановление из кислородных соединений сильными восстановителями.
3Mg + B2O3 =3MgO +2B
По приведенной реакции в настоящее время получают аморфный бор.
Кристаллический бор получают восстановлением галогенидов при температуре 12000 С.
2BCl3 = 2B + 3Cl2
Физические свойства
К настоящему времени описано два аллотропных видоизменения бора:
Аморфный бор представляет собой бурый порошок без запаха и вкуса. Плохо проводит тепло и электрический ток.
Кристаллический бор – гранатово-красные кристаллы квадратной системы, хрупкие и твердые.
Следует отметить одно важное обстоятельство, связанное с описанием физических свойств этого элемента. Поскольку бор обладает высоким сродством к другим элементам, то пока не удалось получить бор без посторонних примесей. Между тем даже самые незначительные примеси – десятые и сотые доли % - существенно влияют на свойства элемента.
Химические свойства
Бор обладает и восстановительными и окислительными свойствами,
напоминая углерод и особенно кремний.
Взаимодействие с простыми веществами
1. на воздухе бор не реагирует с кислородом, но при нагревании до 7000 С сгорает, образуя оксид:
4B + 3O2= 2B2O3
2. при комнатной температуре бор реагирует только с фтором:
2B + 3F2= 2BF3
3. взаимодействуя с азотом при температуре выше 9000 С, образуя нитрид:
2B + N2= 2BN
4. при нагревании до более высоких температур элемент образует бориды:
2B + 3Mg= Mg3B2
Взаимодействие со сложными веществами
1. при нагревании до 5500 С бор реагирует с водой
2B + 3H2O= B2O3 + 3H2
2. концентрированные кислоты серная или азотная, окисляют бор до борной кислоты:
B + 3HNO3 = H3BO3 + 3NO2
3. аморфный бор медленно реагирует с крепкими растворами щелочей, при нагревании:
2B +2NaOH + 2 H2O = NaBO2 + 3H2
Кристаллический бор устойчив к действию щелочей. Лишь в расплавленных щелочах в присутствии окислителей реакция возможна:
2B +6KOH сплавление 2KBO2 + 2K2O + 3H2
Бор с водородом не взаимодействует, но бороводороды (бораны) могут быть получены при: действии соляной кислоты на борид магния. В этом случае образуется смесь, содержащая В2Н6, В4Н10, В5Н11, В6Н10, В10Н11.
Бора оксид B2O3
В природе в свободном состоянии не встречается.
Физические свойства
Стекловидная гигроскопичная масса, растворяется в воде с образованием борной кислоты H3BO3
B2O3 + 3H2O= 2H3BO3
Борная кислота H3BO3
Получение
Встречается в природе, но может быть получена действием растворов кислот на тетраборат натрия:
Na2B4O7 + H2SO4 + 5H2O = 4H3BO3 + Na2SO4
Na2B4O7 + 2HCl + 5H2O = 4H3BO3 + 2NaCl
Физические свойства
Белый порошок, плохо растворяется в холодной воде, при нагревании растворимость повышается. При охлаждении кристаллизуется в виде без цветных чешуйчатых кристаллов, с характерным перламутровым блеском.
Химические свойства
Слабая кислота, она слабее угольной кислоты и сероводорода.
1. при нагревании теряет воду.
2H3BO3= B2O3 + 3H2O
Борная кислота не образует солей, отвечающих её ортоформе. Все известные соли являются производными её конденсированных форм – тетра- или метаборной кислот.
2. при действии едкого натра образует тетроборат натрия:
4H3BO3 + 2NaOH = Na2B4O7+ 7H2O
Na2B4O7 ∙ 10Н2О - бура.
3. Качественная реакция
Этиловый спирт и концентрированная серная кислота при взаимодействии с сухой борной кислотой или сухими боратами образует борноэтиловый эфир, который при горении дает пламя с ярко-зеленой окраской
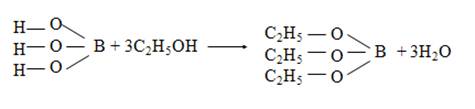
Биологическая роль, применение в медицине и народном хозяйстве бора и его соединений.
Бор наряду с марганцем, медью, молибденом и цинком входит в число пяти важнейших микроэлементов, необходимых растительным и животным организмам. Установлено, что бор влияет на углеводный и белковый обмен.
В медицине применяются борная кислота и бура в качестве антисептиков.
Борные удобрения (осажденные бораты магния) широко используются в сельском хозяйстве.
Чистый бор очень широко используется в атомных реакторах, используется в производстве сплавов на основе черных и цветных металлов для повышения их износостойкости и жаропрочности.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 21520; Нарушение авторских прав?; Мы поможем в написании вашей работы!