
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Газ Ван-дер-Ваальса
|
|
|
|
 Поведінка реальних газів описується рівнянням Менделєєва–Клапейрона тільки при невисоких тисках і високих температурах. При підвищенні тиску і зменшенні температури спостерігаються значні розбіжності теорії та експерименту. Причин цьому дві: 1) власні розміри молекул; вони і зменшують об’єм, доступний для руху частинок, при нормальних умовах він складає 0,07 % об’єму посудини з газом, а при 100 атм. вже 70%; 2) складний характер взаємодії між молекулами. Типова крива залежності енергії взаємодії від відстані r між їхніми центрами приведений на малюнку. На малих відстанях молекули відштовхуються, на великих – притягаються. Ці причини можна врахувати шляхом введення поправок у рівняння стану ідеального газу, що і зробив Ван-дер-Ваальс. У результаті рівняння стану одного моля реального газу прийняло вигляд:
Поведінка реальних газів описується рівнянням Менделєєва–Клапейрона тільки при невисоких тисках і високих температурах. При підвищенні тиску і зменшенні температури спостерігаються значні розбіжності теорії та експерименту. Причин цьому дві: 1) власні розміри молекул; вони і зменшують об’єм, доступний для руху частинок, при нормальних умовах він складає 0,07 % об’єму посудини з газом, а при 100 атм. вже 70%; 2) складний характер взаємодії між молекулами. Типова крива залежності енергії взаємодії від відстані r між їхніми центрами приведений на малюнку. На малих відстанях молекули відштовхуються, на великих – притягаються. Ці причини можна врахувати шляхом введення поправок у рівняння стану ідеального газу, що і зробив Ван-дер-Ваальс. У результаті рівняння стану одного моля реального газу прийняло вигляд:
 .
.
Отримане рівняння називається рівнянням Ван-дер-Ваальса або рівнянням стану реального газу. Тут а і b – постійні Ван-дер-Ваальса, для різних газів вони мають свої значення. Поправка в перших дужках  обумовлена силами притягання між молекулами. Вона має розмірність тиску, і її іноді називають внутрішнім тиском. На стінку посудини такий газ створює тиск р. Однак, якщо б сили притягання між молекулами миттєво зникли, той тиск на стінки дорівнював би р+
обумовлена силами притягання між молекулами. Вона має розмірність тиску, і її іноді називають внутрішнім тиском. На стінку посудини такий газ створює тиск р. Однак, якщо б сили притягання між молекулами миттєво зникли, той тиск на стінки дорівнював би р+ . Тобто, при переході від ідеального газу до реального тиск на стінку зменшується через сили притягання між молекулами. Поправка b пов'язана з власним обс’ємом молекул, її розмірність м3/моль.
. Тобто, при переході від ідеального газу до реального тиск на стінку зменшується через сили притягання між молекулами. Поправка b пов'язана з власним обс’ємом молекул, її розмірність м3/моль.
Внутрішня енергія газу Ван-дер-Ваальса складається із сумарної кінетичної енергії молекул у Ц – системі і сумарній енергії взаємодій молекул:
 .
.
Для знаходження власної потенціальної енергії скористаємося тим, що робота сил притягання дорівнює збитку потенціальної енергії:  . Сили притягання характеризуються внутрішнім тиском р =
. Сили притягання характеризуються внутрішнім тиском р =  . Тоді елементарна робота цих сил
. Тоді елементарна робота цих сил 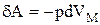 , де знак мінус обумовлений тим, що при розширенні газу робота повинна бути негативною. Після підстановки одержуємо:
, де знак мінус обумовлений тим, що при розширенні газу робота повинна бути негативною. Після підстановки одержуємо:
 або
або 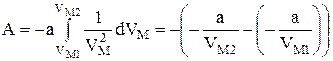 .
.
Оскільки робота дорівнює збитку власної потенціальної енергії, то можна записати: 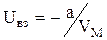 . Сумарна кінетична енергія залежить від поступального і внутрішнього рухів молекул, і визначається як
. Сумарна кінетична енергія залежить від поступального і внутрішнього рухів молекул, і визначається як 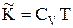 . Таким чином, внутрішня енергія моля газу Ван-дер-Ваальса:
. Таким чином, внутрішня енергія моля газу Ван-дер-Ваальса:
 .
.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 441; Нарушение авторских прав?; Мы поможем в написании вашей работы!