
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема: Молекулярно-кінетична теорія. Гіпотеза про рівнорозподіл енергії по ступенях волі. Розподіл Максвелла
Лекція № 15.
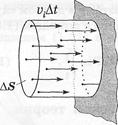 Визначимо фізичну природу і зміст термодинамічних параметрів (тиску, температури і внутрішньої енергії). Розглянемо модель ідеального газу, у якій: 1) молекули газу не взаємодіють між собою; 2) у рівноважному стані рух молекул хаотичний, тобто вони рухаються в напрямках Х, У і Z, і при цьому, якщо в одиниці об'єму мається n молекул, то в кожній з цих напрямків рухається по n/3 молекул, або n/6 в одну сторону.
Визначимо фізичну природу і зміст термодинамічних параметрів (тиску, температури і внутрішньої енергії). Розглянемо модель ідеального газу, у якій: 1) молекули газу не взаємодіють між собою; 2) у рівноважному стані рух молекул хаотичний, тобто вони рухаються в напрямках Х, У і Z, і при цьому, якщо в одиниці об'єму мається n молекул, то в кожній з цих напрямків рухається по n/3 молекул, або n/6 в одну сторону.
Фізичний зміст тиску. Нехай газ знаходиться в циліндрі площею DS і довжиною 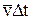 , де
, де 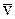 – середня швидкість руху молекул. Визначимо тиск, який створюють на елементарну площу DS молекулами, що рухаються в напрямку стінки і за час Dt встигають до неї долетіти. Число молекул, що вдарилися об стінку за заданий час, дорівнює:
– середня швидкість руху молекул. Визначимо тиск, який створюють на елементарну площу DS молекулами, що рухаються в напрямку стінки і за час Dt встигають до неї долетіти. Число молекул, що вдарилися об стінку за заданий час, дорівнює:
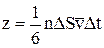 ,
,
де n – концентрація, тобто число молекул в одиниці об'єму.
Визначимо середню силу удару молекул об поверхню. Нехай 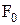 – сила удару однієї молекули. Тоді сила тиску на поверхню за час Dt може бути визначена як сумарна сила удару всіх молекул за цей час:
– сила удару однієї молекули. Тоді сила тиску на поверхню за час Dt може бути визначена як сумарна сила удару всіх молекул за цей час: 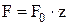 . Визначимо силу удару однієї молекули об стінку. Будемо вважати, що кожна молекула, налетів на стінку нормально, у результаті зіткнення з нею відлітає в протилежному напрямку. До зіткнення зі стінкою молекула мала імпульс
. Визначимо силу удару однієї молекули об стінку. Будемо вважати, що кожна молекула, налетів на стінку нормально, у результаті зіткнення з нею відлітає в протилежному напрямку. До зіткнення зі стінкою молекула мала імпульс 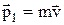 і після зіткнення при зробленому припущенні – імпульс
і після зіткнення при зробленому припущенні – імпульс  . Приріст імпульсу молекули в результаті зіткнення:
. Приріст імпульсу молекули в результаті зіткнення:
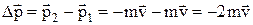 .
.
Відповідно до закону збереження імпульсу такий же імпульс, але в протилежному напрямку, одержала стінка: 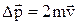 . За другим законом Ньютона сила удару однієї молекули об стінку:
. За другим законом Ньютона сила удару однієї молекули об стінку: 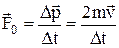 . Після підстановки одержуємо формулу для розрахунку модуля сили удару молекул об стінку:
. Після підстановки одержуємо формулу для розрахунку модуля сили удару молекул об стінку:
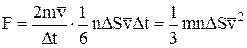 .
.
Розділивши ліву і праву частини останнього рівняння на DS, одержуємо формулу тиску ідеального газу на поверхню:
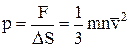 .
.
Помноживши чисельник і знаменник на 2, одержуємо:
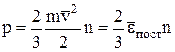 .
.
де 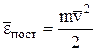 – середня кінетична енергія поступального руху однієї молекули. Отримане рівняння називається основним рівнянням молекулярно–кінетичної теорії ідеального газу. Воно розкриває фізичний зміст макропараметра р: тиск газу на стінку визначається середнім значенням поступальної кінетичної енергії руху молекул.
– середня кінетична енергія поступального руху однієї молекули. Отримане рівняння називається основним рівнянням молекулярно–кінетичної теорії ідеального газу. Воно розкриває фізичний зміст макропараметра р: тиск газу на стінку визначається середнім значенням поступальної кінетичної енергії руху молекул.
Фізичний зміст температури Т. Зіставимо отримане вираження для тиску газу з рівнянням стану ідеального газу:
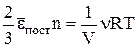 .
.
Враховуючи, що 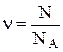 ,
, 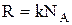 ,
, 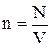 , одержуємо:
, одержуємо: 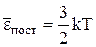 , відкіля випливає фізичний зміст абсолютної температури: Температура – міра середньої кінетичної енергії поступального руху молекул газу.
, відкіля випливає фізичний зміст абсолютної температури: Температура – міра середньої кінетичної енергії поступального руху молекул газу.
Підставивши в основне рівняння МКТ вираження для кінетичної енергії, одержимо:
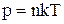 .
.
Якщо в посудині знаходиться суміш газів, то тиск суміші може бути знайдений за формулою: 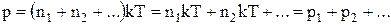 . Отримане рівняння являє собою математичний запис закону Дальтона: Тиск суміші газів дорівнює сумі парціальних тисків кожного газу окремо.
. Отримане рівняння являє собою математичний запис закону Дальтона: Тиск суміші газів дорівнює сумі парціальних тисків кожного газу окремо.
 Гіпотеза про рівнорозподіл енергії по ступенях волі. Ступенем волі називають число незалежних координат, що визначають положення молекули. Для визначення положення центра мас молекули необхідно задати три координати. Це означає, що молекула має три поступальних ступені волі. Якщо молекула двохатомна і тверда, то крім трьох поступальних ступенів волі, вона має і дві обертальні, що зв'язані з кутами повороту навколо двох перпендикулярних осей, які проходять через центр мас системи С. Таким чином, тверда двохатомна молекула має п'ять ступенів волі: три поступальних і дві обертальних. Якщо молекула пружна, то можливі коливання атомів і необхідний ще один ступінь волі. Її називають коливальною. Той факт, що середня енергія поступального руху молекули дорівнює
Гіпотеза про рівнорозподіл енергії по ступенях волі. Ступенем волі називають число незалежних координат, що визначають положення молекули. Для визначення положення центра мас молекули необхідно задати три координати. Це означає, що молекула має три поступальних ступені волі. Якщо молекула двохатомна і тверда, то крім трьох поступальних ступенів волі, вона має і дві обертальні, що зв'язані з кутами повороту навколо двох перпендикулярних осей, які проходять через центр мас системи С. Таким чином, тверда двохатомна молекула має п'ять ступенів волі: три поступальних і дві обертальних. Якщо молекула пружна, то можливі коливання атомів і необхідний ще один ступінь волі. Її називають коливальною. Той факт, що середня енергія поступального руху молекули дорівнює 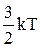 означає, що на кожну ступінь волі в середньому приходиться енергія
означає, що на кожну ступінь волі в середньому приходиться енергія 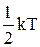 . Больцман узагальнив цей висновок у вигляді гіпотези про рівний розподіл середньої енергії по ступенях волі. При цьому на коливальний ступінь волі повинні приходитися в середньому по дві половинки kт – одна у вигляді кінетичної і одна у вигляді потенціальної. В остаточному підсумку формула середньої енергії молекули приймає вигляд:
. Больцман узагальнив цей висновок у вигляді гіпотези про рівний розподіл середньої енергії по ступенях волі. При цьому на коливальний ступінь волі повинні приходитися в середньому по дві половинки kт – одна у вигляді кінетичної і одна у вигляді потенціальної. В остаточному підсумку формула середньої енергії молекули приймає вигляд:
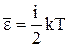 ,
,
де і – число ступенів волі: 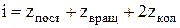 .
.
Фізичний зміст внутрішньої енергії. Визначимо внутрішню енергію моля ідеального газу, як добуток середньої енергії однієї молекули на кількість молекул: 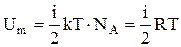 . Враховуючи, що
. Враховуючи, що 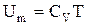 , одержуємо:
, одержуємо:
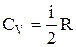 і
і 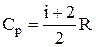 .
.
Постійна адіабати при цьому дорівнює:
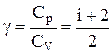 .
.
 Відповідно до цієї формули для молекули одноатомної g = 1,67, твердої двохатомної g = 1,40 і пружної двохатомної g = 1,29. Ці значення добре погодяться з дослідними даними в області кімнатних температур. Однак при розширенні температурного інтервалу спостерігалися розбіжності теорії та експерименту. Протиріччя були цілком розв’язані тільки в рамках квантової теорії. Відомо, що обертальна і коливальна енергії квантовані. Їхні рівні визначаються відповідно формулами:
Відповідно до цієї формули для молекули одноатомної g = 1,67, твердої двохатомної g = 1,40 і пружної двохатомної g = 1,29. Ці значення добре погодяться з дослідними даними в області кімнатних температур. Однак при розширенні температурного інтервалу спостерігалися розбіжності теорії та експерименту. Протиріччя були цілком розв’язані тільки в рамках квантової теорії. Відомо, що обертальна і коливальна енергії квантовані. Їхні рівні визначаються відповідно формулами:
 ,
, 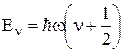 ,
,
де r – обертальне квантове число, n – коливальне квантове число, І – момент інерції відносно головної осі, w – власна частота коливань, 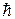 – стала Планка.
– стала Планка.
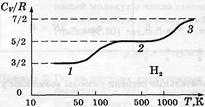
З цих формул випливає, що мінімальна обертальна енергія молекули Н2 дорівнює порядку однієї сотої еВ. І при такій низькій температурі як 50 К середня енергія поступального руху молекули вдвічі менше мінімальної обертальної енергії. Тобто, її виявляється недостатньо, щоб збудити обертальні ступені волі. В області температур ~ 500 К обертальні ступені волі цілком розморожені, і молекула Н2 поводиться як тверда двохатомна молекула з числом ступенів волі 3+2 = 5. При температурах, що перевищують 1000 К, енергії уже виявляється досить для поступового порушення коливальної ступені волі.
|
|
Дата добавления: 2014-01-04; Просмотров: 419; Нарушение авторских прав?; Мы поможем в написании вашей работы!