
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Другий початок термодинаміки. Ентропія
|
|
|
|
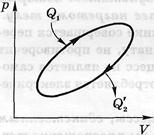 Перший початок термодинаміки являє собою узагальнення закону збереження енергії на теплові явища. Воно встановлює кількісні співвідношення між перетвореннями одних видів енергії в інші. Другий початок визначає умови, при яких можливі ці перетворення, а також можливі напрямки протікання процесів.
Перший початок термодинаміки являє собою узагальнення закону збереження енергії на теплові явища. Воно встановлює кількісні співвідношення між перетвореннями одних видів енергії в інші. Другий початок визначає умови, при яких можливі ці перетворення, а також можливі напрямки протікання процесів.
Розглянемо схему роботи теплової машини, робочім тілом у якій є ідеальний газ. Будь який тепловий двигун працює за замкнутим циклом. Якщо процес відбувається за годинною стрілкою, то робота, що виконується двигуном за цикл, позитивна: А > 0. Нехай Q1 – поглинене за цикл тепло, a Q2 - віддане тепло (Q2 > 0). Дослід показує, що тепло Q2 неминуче існує в будь–якому тепловому двигуні. У відповідності з першим початком, за цикл збільшення внутрішньої енергії робочої речовини 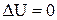 , тому
, тому  . Ефективність теплового двигуна визначають його ККД, що дорівнює відношенню корисної роботи газу до отриманої їм кількості теплоти:
. Ефективність теплового двигуна визначають його ККД, що дорівнює відношенню корисної роботи газу до отриманої їм кількості теплоти:
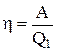 , или
, или  .
.
Теоретично можливі процеси, при яких уся кількість теплоти, що отримана робочим тілом від нагрівача, буде перетворена в корисну роботу, тобто Q2 = 0 і h=1, однак у природі такі процеси не спостерігаються. Ця об'єктивна закономірність відображена у другому початку термодинаміки. Існує кілька формулювань другого початку.
1. Клаузіус (1850): неможливий самодовільний перехід тепла від менш до більш нагрітого тіла, або неможливі процеси, єдиним кінцевим результатом яких був би перехід тепла від менш до більш нагрітого тіла.
Той факт, що, наприклад, у холодильнику відбувається перехід тепла від холодильної камери в кімнату, не суперечить цьому твердженню, оскільки цей процес не є самодовільним: для його здійснення споживається електрична енергія.
2. Кельвін (1851): неможливі процеси, єдиним кінцевим результатом яких було би перетворення тепла цілком у роботу.
З другого початку термодинаміки випливає, що ККД теплового двигуна завжди менше одиниці, тобто теплові процеси необоротні. Необоротність теплових процесів полягає в тім, що при поверненні системи у вихідний стан відбуваються необоротні зміни станів навколишніх тіл.
Для характеристики стану системи при теплових процесах Клаузіус увів поняття ентропії S. Ентропія вводиться через її елементарне збільшення, як:
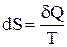 .
.
Слід зазначити, що збільшення ентропії не залежить від процесу, а визначається тільки початковим та кінцевим станами системи, тобто ентропія – функція стану. В інтегральній формі отримане вираження має вигляд:
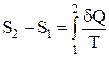 ,
,
Тобто, різниця ентропій у двох рівноважних станах дорівнює приведеній кількості теплоти, яку треба передати системі, щоб перевести її зі стану 1 у стан 2.
Властивості ентропії:
- ентропія – функція стану. Якщо процес проводять адіабатично, то ентропія системи не змінюється. Це означає, що адіабати є одночасно і ізоентропи. Кожної більш "високо" розташованій адіабаті відповідає більше значення ентропії;
- ентропія – величина аддитивна, тобто ентропія макросистеми дорівнює сумі ентропій окремих її частин;
- ентропія замкнутої макросистеми не зменшується – вона або зростає, або залишається сталою.
Оскільки 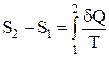 , і в ідеально теплоізольованій системі
, і в ідеально теплоізольованій системі  , то одержуємо:
, то одержуємо: 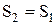 , тобто ентропія системи не змінюється. У реальних процесах тепло переходить від більш до менш нагрітих тіл, тому зміна ентропії кожного тіла дорівнює:
, тобто ентропія системи не змінюється. У реальних процесах тепло переходить від більш до менш нагрітих тіл, тому зміна ентропії кожного тіла дорівнює:
 ,
, 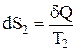 , де
, де  .
.
Сумарна зміна ентропії: 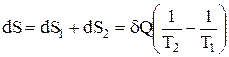 , тобто
, тобто  .
.
Принцип зростання ентропії замкнутих систем являє собою ще одне формулювання другого початку термодинаміки: Усі реальні теплові процеси супроводжуються зростанням ентропії.
Теорема Нернста. У 1906 році Нернст відкрив закон, що називають теоремою Нернста або третім початком термодинаміки: При наближенні температури до абсолютного нуля ентропія макросистеми також наближається до нуля:
 при
при  ,
,
і абсолютне значення ентропії можна обчислювати за формулою:
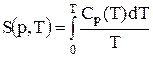 .
.
З останньої рівності випливає, що при  теплоємність усіх макросистем повинна також прямує до нуля, при цьому всі процеси будуть відбуватися без зміни ентропії.
теплоємність усіх макросистем повинна також прямує до нуля, при цьому всі процеси будуть відбуватися без зміни ентропії.
Основне рівняння термодинаміки являє собою об'єднання ентропії з першим початком термодинаміки. Оскільки 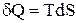 , і
, і 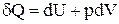 , то в підсумку одержуємо:
, то в підсумку одержуємо:
 .
.
Розрахуємо за допомогою отриманого рівняння ентропію ідеального газу. Нехай початковий і кінцевий стани газу визначаються параметрами  . З огляду на те, що
. З огляду на те, що  і
і 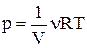 , основне рівняння термодинаміки можна переписати у вигляді:
, основне рівняння термодинаміки можна переписати у вигляді:  . Продифференціюємо логарифм від рівняння Менделєєва–Клапейрона:
. Продифференціюємо логарифм від рівняння Менделєєва–Клапейрона:  ,
, 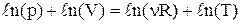 . Узявши диференціал від останнього рівняння, одержуємо:
. Узявши диференціал від останнього рівняння, одержуємо: 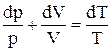 . Підставивши отриману рівність у формулу зміни ентропії, одержуємо:
. Підставивши отриману рівність у формулу зміни ентропії, одержуємо:
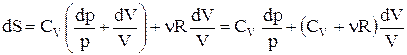 .
.
Але, відповідно до рівняння Майера для n молів газу: 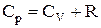 . В остаточному підсумку формула зміни ентропії має вигляд:
. В остаточному підсумку формула зміни ентропії має вигляд: 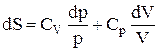 . Проінтегрувавши останнє вираження, одержимо рівняння зміна ентропії ідеального газу в системі pV:
. Проінтегрувавши останнє вираження, одержимо рівняння зміна ентропії ідеального газу в системі pV:
 .
.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1263; Нарушение авторских прав?; Мы поможем в написании вашей работы!