
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Будова
|
|
|
|
План
Лекція №18
Тема: Оксикарбонові кислоти. Оптична ізомерія.
1. Будова. Номенклатура. Ізомерія.
2. Оптична ізомерія.
3. Методи добування.
4. Фізичні та хімічні властивості.
Оксикарбонові кислоти (оксикислоти), або спиртокислоти, - це органічні сполуки, молекули яких містять одночасно карбоксильну і гідроксильну групи. Отже, оксикислоти є біфункціональними органічними сполуками. Кількість функціональних груп в оксикислотах може бути різна: одна гідроксильна і одна карбоксильна, дві гідроксильні і одна карбоксильна, дві гідроксильні і дві карбоксильні.
Оксикислоти можна розглядати як гідроксильні похідні відповідних органічних кислот:
До насичених карбонових кислот відносять:
| Н3С-СООН оцтова | НО-СН2-СООН оксиоцтова, або гліколева | |
| Н3С-СН2-СООН пропіонова |  Н3С-СН-СООН і
ОН
α-оксипропіонова (молочна) кислота Н3С-СН-СООН і
ОН
α-оксипропіонова (молочна) кислота
|  Н2С-СН2-СООН
ОН
β-оксипропіонова Н2С-СН2-СООН
ОН
β-оксипропіонова
|
Двохосновні
| НООС-СН2-СН2-СООН янтарна | НООС-СН2-СН-СООН
ОН оксиянтарна, або яблучна | ||||||||||
НООС-СН-СН-СООН
ОН ОН диоксиянтарна, або винна |
Гомологічний ряд оксикислот починається з оксимурашиної кислоти НО-СООН, яка називається вугільною. Ця кислота нестійка і легко розкладається на СО2 і Н2О.
ОН
 |
 НООС-СН2-С-СН2-СООН
НООС-СН2-С-СН2-СООН
СООН лимонна кислота
3-гідрокси-1,3,5-пентантріол.
Ненасичені оксикислоти мають менше значення.
Ароматичні оксикислоти:

саліцилова, оксигідроксобензойна
1,2-оксибензенкарбонова кислота.
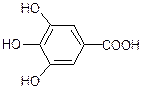
галова кислота (використовується в дубильних речовинах).
Оксикислоти класифікують за основністю і за атомністю. Кількість карбоксильних груп вказує на основність кислоти, а кількість гідроксильних груп, враховуючи і гідроксил карбоксилу – на її атомність. Наприклад, оксиоцтова кислота, α- і β-оксипропіонові кислоти є одноосновними двохатомними оксикислотами, а яблучна кислота – двохосновною трьохатомною оксикислотою, винна – двохосновною чотирьохатомною.
Номенклатура. Для оксикислот використовують переважно історичні назви, які походять від назв природних джерел знаходження цих оксикислот. Так, α-оксипропіонова кислота вперше була знайдена в кислому молоці і тому її називають молочною кислотою; оксиянтарна кислота вперше знайдена в яблуках і її називають яблучною; диоксиянтарна кислота міститься у винограді і тому її називають виноградною.
Часто оксикислоти називають за назвою відповідних карбонових кислот, позначаючи грецькими буквами положення спиртової групі в молекулі відносно карбоксилу, наприклад: α-оксипропіонова, β-оксипропіонова.
За систематичною номенклатурою назву оксикислоти утворюють з назви відповідної карбонової кислоти, перед якою ставлять префікс окси - (гідрокси -), що вказує на наявність ОН-групи в молекулах цих кислот. Місце положення гідроксильної групи в ланцюгу вказують номером вуглецевого атома, з яким вона сполучена (наприклад, 2-оксипропанова кислота).
Ізомерія в ряду оксикислот залежить від структури вуглецевого ланцюга і положення спиртового гідроксилу. Наступний гомолог ряду оксикислот існує у вигляді двох ізомерів - α-оксипропіонової і β-оксипропіонової кислот, які відрізняються положенням спиртового гідроксилу. Одноосновна оксикислота з 4-ма вуглецевими атомами може існувати у вигляді 5-ти структурних ізомерів:
Н3-С-СН2-СН-СООН
ОН 2-оксибутанова, або α-оксимасляна кислота | Н3-С-СН-СН2-СООН
ОН 3-оксибутанова, або β-оксимасляна кислота | |||||||||||||
Н2С-(СН2)2-СООН
ОН 4-оксибутанова, або γ-оксимасляна кислота | Н2С-СН-СООН
НО СН3 2-метил-3-оксипропанова кислота | |||||||||||||
СН3
Н3С-С-СООН
ОН 2-метил-2-оксипропанова кислота |
Перші 3 з наведених оксикислот є ізомерами, які відрізняються положенням спиртового гідроксилу, ізомерія останніх зумовлена ще й розгалуженням вуглецевого ланцюга. Крім того, оксикислоти, молекули яких містять асиметричні атоми вуглецю існують ще у вигляді оптичних ізомерів.
2. Оптична ізомерія. Відомо багато речовин, які здатні обертати (змінювати) площину поляризації світла, тобто відхиляти її вправо (за годинниковою стрілкою), або вліво (проти годинникової стрілки). Ця здатність речовин названа оптичною активністю, а самі речовини, що мають таку здатність, - оптично активними. Оптично активні речовини існують у вигляді оптичних ізомерів.
Якщо світло пропустити крізь призму Ніколя, то ця призма пропустить тільки ті частинки світла, коливання яких відбувається в первинній площині. Таке світло називають поляризованим. Площина, перпендикулярна до площини коливання частинок поляризованого світла, є площиною поляризації.
α - кут обертання площини поляризації.
Величину кута обертання визначають на спеціальному приладі – поляриметрі.
Якщо речовина обертає площину поляризації праворуч називається правообертаючою (+), якщо ліворуч – лівообертаючою (-).
Існування оптично активних ізомерів, що відхиляють площину поляризації світла вліво і вправо, пояснили в 1874 р. вчені Я. Вант-Гофф і Ж.Ле-Бель. Вчені сформулювали стереохімічну гіпотезу, що стала потім теорією. Основні положення цієї теорії можна сформулювати так:
1. Оптично активні речовини, як правило, містять асиметричні атоми вуглецю, які позначають зірочкою: С*. Асиметричним називається атом вуглецю, сполучений з чотирма різними атомами або групами атомів (лігандами). Наприклад, гліцериновий альдегід, молочна кислота містять один асиметричний атом вуглецю:
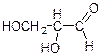
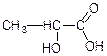
Існують органічні речовини, які мають не тільки один, а два, три і більшу кількість асиметричних вуглецевих атомів. Оптична активність може бути зумовлена наявністю в молекулі інших асиметричних атомів.
2. Молекули, які містять асиметричні атоми вуглецю, несиметричні, тому що в них немає таких елементів, як центр і площина симетрії. Несиметричні молекули не можна сумістити з їх дзеркальним відображенням. Тому такі молекули називають хіральними.
3. Молекули з асиметричними атомами вуглецю існують у вигляді правих (+)-форм (конфігурацій) і лівих (-)-форм (конфігурацій), тобто у вигляді стереоізомерів, які відрізняються різним розміщенням лігандів у просторі навколо асиметричного атома С*. Правий і лівий стереоізомери дзеркально подібні між собою, але не сумісні (хіральні), або енантіоморфні. Отже, оптична (дзеркальна) ізомерія – це вид просторової ізомерії, при якій стереоізомери відрізняються розміщенням у просторі лігандів навколо асиметричного атома вуглецю, але подібні між собою як предмет і його дзеркальне відображення, тобто є енантіоморфними.
Право (+)- і ліво (-)- обертаючи ізомери мають однакову структуру (однакову послідовність хімічних зв’язків у молекулі), однакові t0кип. і t0плавл., розчинність, теплопровідність, електропровідність тощо, але розрізняються між собою такими властивостями:
1) у рідкому, газоподібному станах і в розчинах вони відхиляють площину поляризації світла на однаковий кут, але в протилежних напрямках;
2) обидва ізомери кристалізуються в енантіоморфних (дзеркально протилежних) формах один відносно другого, тобто є оптичними антиподами;
3) право (+)- і ліво (-)- обертаючі ізомери відрізняються реакційною здатністю відносно інших оптично активних реагентів;
4) ці ізомери виявляють різну фізіологічну дію на живі організми;
5) при змішуванні рівномолярних кількостей (+)- і (-)- ізомерних форм утворюються оптично неактивні сполуки, які називають рацематами і позначають ч(і).
Дзеркальне відображення моделей молекул
(+)- і (-)- молочних кислот:

Зображення за Ньюменом:
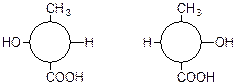
Е. Фішер у 1891 р. запропонував для зручності і простоти зображати стереоізомери у вигляді проекційних формул, які являють собою проекції тетроядричних моделей відповідних молекул на площину.
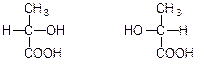
Конфігурація і знак обертання. У стереохімії розрізняють поняття абсолютної конфігурації, тобто дійсного просторового розміщення лігандів у оптично активному стереоізомері, я відносної конфігурації, в якій розміщення лігандів порівнюють зі стандартним (опорним) стереоізомером.
Позначення D і L означають конфігурацію оптично активної речовини (D – правообертаюча; L – лівообертаюча), а знаки (+)- і (-)- напрямок обертання площини поляризації світла оптично активною речовиною.
Абсолютна конфігурація за Інгольдом:
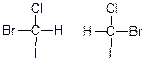
В даній конфігурації дивляться на молекулярну масу замісників (беруть найміцніший).
R- i S-ряди, що вказують на конфігурацію оптично активної речовини.
(+)- і (-)- фізична характеристика що залежить від природи замісників.
Винна кислота:
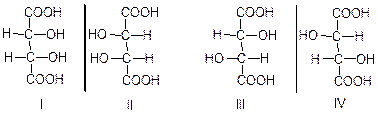
І і ІІ – ідентичні сполуки (мезовинна кислота)
ІІІ і ІV – дзеркальні ізомери (просторові) і називаються енантіомерами
ІІІ - Д(+) – винна кислота
ІV - L(-) – винна кислота
Мезовинна кислота оптично неактивна.
Таким чином ми бачимо, що просторові ізомери з іншими ізомерами не є дзеркальними ізомерами (антиподами). Такі сполуки називають діастереоізомерами.
 І по відношенню до ІІІ
І по відношенню до ІІІ
є діастереоізомерами
ІІ по відношенню до ІІІ
Якщо змішати ІІІ і ІV – утворюється суміш структур, яка є оптично неактивною називається рацемічною сумішшю.
Рацемічна суміш Д (+, -) – винна кислота.
Рацемічна суміш може бути розділена на оптично активні ізомери, в той час, як для мезоформи це неможливо.
3. Методи добування.
1) неповне окислення гліколей;

2) з галогензаміщених кислот;
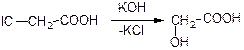
3) з альдегідів та кетонів через оксинитрил;
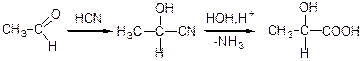
4) приєднання Н2О до ненасичених кислот;

5) окислення ненасичених кислот за Вагнером;
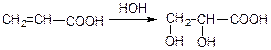
6) відновлення альдегідо- та кетокислот;
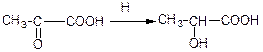
7) бродіння цукрів.
Ароматичні оксикислоти:
Саліцилову кислоту добувають за синтезом Кольба і відбувається за механізмом електрофільного заміщення:
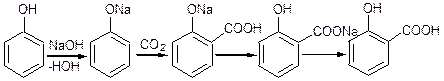
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1395; Нарушение авторских прав?; Мы поможем в написании вашей работы!
