
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Фізичні та хімічні властивості.
|
|
|
|
Одноосновні оксикислоти з невеликою молекулярною масою – це густі сироподібні рідини, або тверді речовини. Двохосновні оксикислоти – кристалічні речовини. Оксикислоти краще розчиняються у воді, ніж відповідні їм карбонові кислоти, але обмежено розчиняються в ефірі та інших органічних розчинниках. Мають значно вищі температури плавлення і кипіння, ніж карбонові кислоти з такою самою кількістю вуглецевих атомів. Багато оксикислот виявляють оптичну активність.
Хімічні властивості. Оксикислоти містять дві функціональні групи і їх хімічні властивості визначаються наявністю як карбоксильної, так і гідроксильної груп. Тому оксикислоти одночасно виявляють властивості і карбонових кислот і спиртів. При чому карбоксильна і гідроксильна групи, можуть брати участь у хімічних реакціях окремо, незалежно одна від одної, або обидві разом. Так, оксикислоти, як і карбонові кислоти, у водних розчинах дисоціюють:

Однак оксикислоти, і в першу чергу α-оксикислоти, мають сильніші кислотні властивості, ніж відповідні їм карбонові кислоти. Наприклад, Кд гліколевої (Кд = 1,48·10-4) і α-оксипропіонової (Кд = 1,38·10-4) кислот приблизно в 8-10 разів більші, ніж відповідно оцтової (Кд = 1,75·10-5) і пропіонової (Кд = 1,34·10-5) кислот. Причиною посилення кислотних властивостей оксикислот є – І-ефект спиртової ОН-групи, яка зумовлює зміщення електронів по системі α-зв'язків НО←СН2←С←О←Н.
 |  |
О
Тому атом водню карбоксильної групи легше про тонізується, ніж в карбонових кислотах, і сила оксикислоти зростає. Чим ближче спиртовий гідроксил розміщений до карбоксильної групи, тим сильнішою є оксикислота, оскільки в міру віддалення ОН-групи від СООН-групи вплив – І-ефекту поступово «затухає». Тому β-, j-, δ-оксикислоти виявляють значно меншу кислотність, ніж відповідні їм α-оксикислоти.
Оксикислоти, подібно до карбонових кислот утворюють солі, складні ефіри, аміди:

Етиловий ефір молочної кислоти Лактат натрію
Оксикислоти, вступаючи в реакції, як спирти утворюють алкоголяти, прості ефіри, заміщують гідроксил на галоген. Так, при взаємодії оксикислот з лужними металами, лугами спочатку утворюються солі цих кислот, які далі реагують з цими ж речовинами і дають алкоголяти:

сіль молочної кислоти алкоголят молочної кислоти
При дії на оксикислоти галоген оводнів спиртовий гідроксил їх молекул заміщується на галоген і утворюються відповідні галогенокислоти:
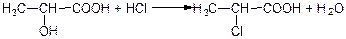
α-оксипропіонова кислота α-хлорпропіонова кислота
PCl5 заміщує на галоген одночасно як спиртовий гідроксил, так і гідроксил карбоксилу:
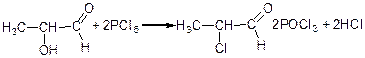
α-оксипропіонова кислота хлорангідрид α-хлорпропіонової кислоти
Оксикислоти, подібно до спиртів, можуть окислюватись. Оксикислоти, що містять первинну ОН-групу, при окисленні перетворюються на альдегідокислоти, а оксикислоти з вторинною ОН-групою – на кетокислоти:

гліколева кислота гліоксалева кислота

Молочна кислота Піровиноградна кислота
Також оксикислотам властиві специфічні реакції, зумовлені взаємним впливом 2-х функціональних груп у їх молекулі.
α-оксикислоти при нагріванні відщеплюють воду міжмолекулярно за рахунок гідроксилу карбоксильної групи однієї молекули оксикислоти і атома водню спиртової групи другої молекули оксикислоти. Продуктами такої дегідратації є циклічні міжмолекулярні складні ефіри, які називають лактидами:

гліколід.
Лактиди – достатньо напружені сполуки. Під дією лугів мінеральних кислот можуть гідролізувати.
j- і δ-оксикислоти при нагріванні вступають у внутрішньо молекулярну етерифікацію між спиртовим гідроксилом і карбоксильною групою, утворюючи внутрішньо молекулярні циклічні складні ефіри, які називають лактонами.

Стереохімія реакції заміщення (інверсія).
Велике теоретичне і практичне значення мають реакції, які відбуваються з участю зв'язків асиметричного атома С*, зокрема реакції заміщення. Такого типу реакції вперше спостерігав і вивчав П. Вальден у 1896 р. Він встановив, що реакції біля асиметричного атома С* у багатьох випадках супроводяться інверсією (обертанням) знака обертання площини поляризації світла. Це явище було назване вальденівським обертанням, тобто зміною конфігурації молекули в процесі реакції без реалізації її продукту.
Зміна або збереження знака обертання, а відповідно і конфігурації молекул, істотно залежить від умов і механізму реакції заміщення.

Хлор янтарна к-та яблучна кислота


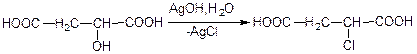
яблучна кислота Хлор янтарна к-та
Отже, заміна біля асиметричного атома С* галогену на гідроксильну групу під час гідролізу водним розчином лугу і заміна біля асиметричного С* ОН-групи на Hal під дією PCl5 відбувається із зміною конфігурації.
Вальденівське обертання дає можливість отримати різні механізми даного процесу.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 2727; Нарушение авторских прав?; Мы поможем в написании вашей работы!