
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекція 15. Основні розрахунки, застосовувані в
|
|
|
|
гальванотехніці.
15.1. Визначення виходу по струму.
При технологічних розрахунках зручніше користатися не числом Фарадея, а ампер-годинами. Відомо, що кількість електрики ∆Q=І∆t. У нашому випадку ∆Q=F значить F=І∆t. Враховуючи те, що F=96500А·с, а в 1 годині 3600с одержимо, що
F=28,8 A*год
тоді  г/А*год
г/А*год
Приклад 1. Електроліз у нікелевій ванні тривав 30 хвилин при І=300A. Осіло на катоді 102г нікелю. Визначити катодний вихід по струму:
 звідси
звідси 
Підставляючи наші дані одержимо:
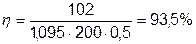
Приклад 2. Визначити яка кількість електрики, у Кл, витрачено при осадженні цинку, якщо маса осаду m=13,07г, К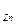 =1,22 г/А*год
=1,22 г/А*год , а η=90
, а η=90
Q=It 

Що в кулонах буде Q=11,9 · 3600=42890Кл.
15.2. Визначення середньої товщини покриття.
 При розрахунках товщини покриття, необхідно пам'ятати, що рівномірного покриття при осадженні на плоскі і рельєфні поверхні не виходить. Розглянемо плоскі електроди. Як видно, силові лінії електричного поля у країв розташовуються густіше чим у центра. Сила струму буде в країв теж більше, а виходить, більше буде і товщина покриття. Тому при визначенні товщини можна говорити тільки про її середнє значення. У розрахунках також вводиться щільність струму
При розрахунках товщини покриття, необхідно пам'ятати, що рівномірного покриття при осадженні на плоскі і рельєфні поверхні не виходить. Розглянемо плоскі електроди. Як видно, силові лінії електричного поля у країв розташовуються густіше чим у центра. Сила струму буде в країв теж більше, а виходить, більше буде і товщина покриття. Тому при визначенні товщини можна говорити тільки про її середнє значення. У розрахунках також вводиться щільність струму  . Найчастіше силу струму вимірюють в А, а площа в дм2 чи см2.
. Найчастіше силу струму вимірюють в А, а площа в дм2 чи см2.
Природно, що щільність струму теж у країв буде більше чим у середині пластини, тому в розрахунках фігурує середнє значення щільності струму.
Приклад 3. Визначити товщину Zn покриття, осадженого з ціаністої ванни за 3 хв,  щільность струму J = 1,5 А/дм2, вихід по струму 90%. К
щільность струму J = 1,5 А/дм2, вихід по струму 90%. К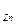 =1,22 г/А*год Визначимо масу Zn, що осів на 1см
=1,22 г/А*год Визначимо масу Zn, що осів на 1см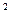 площі катода,, J=1,5 A/дм2 = 0,015 А/см2, тоді
площі катода,, J=1,5 A/дм2 = 0,015 А/см2, тоді

m = ρ·V = ρ·S·δ; де δ – товщина покриття.

звідси 
Таким чином товщина покриття δ = 11мкм.
Приклад 4. Через розчин NіSO4 пропускають струм протягом 12 хв. Визначити величину струму, його щільність і товщину покриття якщо за цей час через розчин проходить 36000 Кл електрики, а активна площа катода S=10дм2, 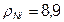 г/см3, η = 95%, K=1,095 г/А·год.
г/см3, η = 95%, K=1,095 г/А·год.
Визначимо скільки ампер-годин складає 36000Кл.
Так як 1Кл = 1А·с,  , то
, то 
Враховуючи, що 12хв = 0,2 год знаходимо силу струму
 Звідси
Звідси 
Товщина покриття може бути визначена:
m = S·δ·ρ,  ;
; 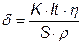 ;
;
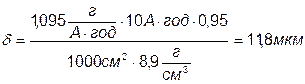
Визначення тривалості процесу.
Приклад 5. Визначити час, необхідний для одержання мідного покриття, з кислої ванни, товщиною 15мкм, при щільності струму J=2A/дм2 з виходом по струму 98%. 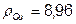 г/см3,
г/см3,  .
.
По закону Фарадея 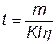
Визначимо масу міді, що виділилася на 1см2 площі:
m = S·ρ·δ,  .
.
Підставляючи це значення в формулу Фарадея одержимо:
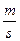 =
=  звідки знаходимо t.
звідки знаходимо t.
Лекція 16. Структура гальванічних покрить
16.1. Будова гальванічних покрить.
Під структурою гальванічних покрить розуміють розмір і форму кристалів з яких складається металеве покриття, і їхнє розташування стосовно поверхні катода.
Гальванічне осадження металів можна розглядати як кристалізацію, що складається з 2-х процесів утворення окремих кристалів і їхнього росту.
У залежності від співвідношення швидкостей кожного з цих процесів виходить та чи інша структура опади.
У тому випадку, коли в початковий момент електролізу, утвориться велике число нових, повільно зростаючих кристалів, метал виділяється у виді дрібнокристалічного осаду. Якщо ж утвориться невелике число кристалів, що швидко ростуть, то метал виходить великокристалічним.
Розміри кристалів неоднакові по товщині шару. Спершу на поверхні катода виділяються дуже дрібні кристали, частина з них, знаходячись у менш сприятливих умовах, припиняє свій ріст, а інша частина продовжує рости. Найбільш сильний вплив на структуру гальванічного осаду робить природа електроліту.
По гіпотезі Ханта, кристалічна структура осаду залежить від концентрації іонів обложеного металу в катодному шарі і концентрації інших складових частин електроліту в цьому ж шарі.
Якщо кількість іонів металу щодо інших частин, що знаходяться в електроліті, порівняно великою, то ріст кристалів не буде зустрічати утруднень і осад буде мати грубокристалічну форму.
Якщо ж унаслідок малого ступеня дисоціації, комплексоутворення, високого ступеня гідратації, присутність колоїдних часток і т.д. концентрація іонів металу в катодному шарі щодо інших складових частин електроліту мала, то ріст кристалів буде утруднений, і швидкість утворення центрів кристалізації буде більше.
Інакше кажучи, всяке утруднення надходження в катодний шар нових іонів металу приведе до утворення дрібнокристалічних опадів.
Механізм кристалізації Хант пояснює так: іон металу, досягаючи катодної поверхні, прагне якомога швидше впровадиться в кристалічну гратку і для цього він повинен звільниться від іонної атмосфери і від оболонки гідратної води. Чим швидше буде рости шар металу і відбуватися осадження поверх даного іона, тим менше шансів цим стороннім тілам знову повернутися в розчин.
Опади Zn, Cu, Cd, Tl, Pb, Sn з розчинів простих солей, наприклад сірчанокислих, виходять, як правило, крупнокристаличними. Так, наприклад, Pb з азотнокислих розчинів осаджується у виді голкоподібних кристалів.
Ця структура абсолютно непридатна для практичних цілей. Краща структура виходить з оцетнокислих розчинів, із кремнієфтористоводневих і ціаністих. Так осадження цинку і міді з розчинів ціанідів дають дуже дрібну кристалічну структуру. Пояснюється це тим, що в розчинах простих солей дисоціація йде в одну стадію з утворенням простих іонів, а в другому випадку дисоціація йде в двох стадіях. В першій стадії утвориться складний комплексний аніон і тільки в другій стадії - іони металу, що осаджується. Крім того, кристали, отримані із сірчанокислого електроліту, розташовуються перпендикулярно площини катода, а з ціаністого електроліту, ростуть безладно, хаотично.
K[Au(CN)2]; K2[Ni(CN)4]; K[Ag(CN)2]; AgCN
Наприклад:
1. Осадження Zn з ZnSO4:
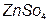 D
D
2. Осадження Zn из CN растворів: [соль Na2[Zn(CN)4]]
 D
D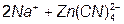 а потім
а потім 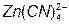 D
D
Тому що комплексний ціаністий аніон дисоціює дуже слабко, то концентрація простих іонів дуже низька. У цих умовах виходять покриття зі значно меншою величиною окремих кристалів, чим у кислих ваннах.
16.2. Вплив катодної поляризації на структуру осаду.
Встановлено, що розряд іонів металу на катоді при більш негативному потенціалі приводить до утворення осадів більш тонкої структури. Ріст зародків, що утворилися, вимагає меншого відхилення від рівноважних умов, тобто протікає при менш негативному потенціалі.
На малюнку зображена крива катодного відновлення Cd з 1н розчину CuSO4 на платиновому катоді. Неполяризований платиновий електрод має більш позитивний потенціал ( ) чим це відповідає рівноважному потенціалу кадмію (
) чим це відповідає рівноважному потенціалу кадмію ( ). При включенні струму, що поляризує, потенціал платинового електрода різко зміщається убік негативних значень, потім він стає більш позитивнішім, і встановлюється на величині, що відповідає процесу електролізу φ.
). При включенні струму, що поляризує, потенціал платинового електрода різко зміщається убік негативних значень, потім він стає більш позитивнішім, і встановлюється на величині, що відповідає процесу електролізу φ.
 Спостерігаючи поверхню катода в мікроскоп, можна в крапці mіn помітити появу першого зародка. Подальший ріст його відбувається при потенціалі φ. Відхилення від рівноважного значення Cd відповідає величині ∆φ1. В умовах протікання процесу електролізу поляризація виражається величиною ∆φ2.
Спостерігаючи поверхню катода в мікроскоп, можна в крапці mіn помітити появу першого зародка. Подальший ріст його відбувається при потенціалі φ. Відхилення від рівноважного значення Cd відповідає величині ∆φ1. В умовах протікання процесу електролізу поляризація виражається величиною ∆φ2.
Оскільки відновлення Cd із сірчанокислого розчину протікає без великої перенапруги, то ∆φ2 незначна, і обумовлена головним чином концентраційними змінами біля поверхні електрода.
Гальмування процесу можна здійснити додаванням в електроліт поверхнево-активних речовин, що здатні пасивувати катод. У такому напрямку діють: декстрин, желатина, клей, фенол і ряд інших речовин. Наприклад, якщо до електроліту, що містить 250г/л мідного купоросу і 30г/л сірчаною кислоти додати 0,01г/л желатини, то структура осаду стає настільки тонкою, що окремі зерна міді в осаді майже нерозрізнені під мікроскопом.
Подібна дія на структуру гальванопокриттів роблять гідрати окислів деяких металів, що утворяться в прикатодному шарі.
Утворення гідратів окислів металів відбувається звичайно в слабокислих чи нейтральних середовищах в умовах спільного виділення металу і водню, коли відбувається підлужування прикатодного шару електроліту (нагромадження іонів OH-). Гідрати окислів осаджуються разом з металом, утворити дрібнокристалічний осад.
При підвищенні змісту гідратів окислів металу якість осаду погіршується: він стає тендітним, темним по кольору, грубошерсткуватим.
Зі збільшенням кислотності розчину гідратоутворення знижується. Особливо помітний вплив робить на структуру покрить концентрація водневих іонів у таких металів як залізо, нікель і кобальт. Водень може поглинатися виділеним металом. В опадах Cr міститься близько 0,45% вагової водню, у Fe, Nі, Co - до 0,1%, у Zn - 0,01-0,001%, а в інших металах ще менше.
Незважаючи на малий зміст водню в металах, в опадах виникають великі внутрішні напруження, що є причиною його відшаровування від основи, утворення міхурів і підвищеної крихкості.
Лекція 17. Вплив режимів електролізу на структуру покрить.
17.1. Компоненти електролізу, що не беруть участь у розряді.
У рідких випадках електроліти складаються тільки з солі чи іншого з'єднання, іони яких розряджаються на катоді з утворенням відповідного покриття. Часто в електроліти вводять солі лужних чи лужноземельних металів з метою підвищення електропровідності, що дозволяє, при більш низькій напрузі на клемах ванни підтримувати підвищену щільність струму. У мідному сірчанокислому електроліті цю роль виконує сірчана кислота, а в станiтних електролітах - луги. Для стабілізації pH розчинів (попередження різких коливань) в електроліти вводять слабкі кислоти - борну (H2BO3), оцтову (CH3COOH), лимонну ((CO2H)42CH2 · C(OH)).
Крім того в розчин, як уже говорилося, уводяться поверхнево-активні речовини.
17.2. Вплив режимів електролізу на структуру осаду.
Режим електролізу (щільність струму, температура, перемішування) дуже впливає на процес кристалізації. Кількість кристалів, що утворяться, при проходженні постійної кількості електрики на катоді тим більше, чим менше концентрація електроліту, вище щільність струму, нижче температура і менше інтенсивність перемішування.
Підвищення щільності струму приводить до зменшення величини кристалів в осаді. Однак у деяких випадках подібна закономірність спостерігається лише з визначеної щільності струму: спочатку відбувається укрупнення кристалів і лише починаючи з визначеною щільністю струму, величина їх зменшується.
Підвищувати щільність струму можна тільки до визначеної межі, після якої починається порушення процесу. Унаслідок сильного збідніння прикатодного шару іонами металу спостерігається відкладення металу на деяких виступаючих ділянках катода, де утворяться т.зв. дендрити. При подальшому підвищенні щільності струму, катод покривається губчатою порошкоподібною масою, що складається з дрібних окремих кристалів чи їхніх зростків, неміцно зв'язаних між собою й основою.
При осадженні Nі, Co, Fe підвищення щільності струму сприятливо впливає на структуру осаду, але з ростом щільності струму росте і кількість виділюваного водню, тому потрібно постійно підтримувати необхідне pH.
Вплив температури на структуру осаду протилежно впливу щільності струму. З підвищенням температури осаду стають більш крупнокристалічні. Такий вплив температури зв'язаний зі збільшенням швидкості дифузії іонів до катода.
У тому ж напрямку, що і підвищення температури діє перемішування електроліту. Воно так само ідентично підвищенню концентрації солі металу, що осаджується, оскільки при цьому швидше заповнюється недолік іонів металу, що розрядилися на катоді. Але з іншої сторони підвищення температури електроліту і перемішування дозволяє одержувати велику щільність струму. У деяких випадках при інтенсивному перемішуванні в метал, що осаджується, попадають часточки шлаку. Тому перемішування часто сполучено з одночасним фільтруванням електроліту.
17.3. Вплив структури основного металу на структуру осаду.
При відповідній підготовці поверхні основного металу його структура відтворюється в шарі, що осаджується, тобто спостерігається спрямована кристалізація - епітаксія. Так мікроструктура відкладеної міді по міді підданій глибокому травленню, відтворює структуру основи, представляючи собою як би її продовження. Якщо ж основний метал піддадуть тільки знежиренню в лужному розчині без травлення, то електроосаджена мідь має волокнисту чи стовпчасту будівлю, характерну для структури електролітної міді.
Таке розходження в структурі осаду можна пояснити тим, що на поверхні металу очищеного лише лугом, може залишитися плівка водню, кисню, чи окису іншої сторонньої речовини. Дія такої плівки хоч і недостатньо для того, щоб перешкодити зчепленню електроосадженого металу однак вона не допускає тісного атомного зіткнення, необхідного для відтворення осадом чи структури продовження росту кристалів основного металу.
При знежиренні і травленні продовження структури основного металу в виділеному шарі спостерігається навіть у тому випадку коли вони відносяться до різних кристалографічних систем.
Продовження росту кристалів основного металу легше здійснюється на крупнокристалічному осаді, хоча й у випадку мілкокристаличної структури такий ефект має місце. Особливо підсилює ефект не просте, а елктрополірування.
Так електроосаджений нікель і хром, по електрополірованій латуні, у шарах порядку 1мкм, мають яскраво виражену структуру латуні. Лише при збільшенні товщини покрить до 10мкм вплив структури основного металу перестає позначатися.
Усе це свідчить про важливість попередньої обробки. Останньою операцією перед зануренням виробів у гальванічні ванни повинне бути легке травлення (декапірування) з наступним промиванням водою.
17.4. Спільний розряд іонів водню і металу на катоді.
При електролізі водяних розчинів можливе виділення на катоді водню, що не тільки позначається на швидкості перебігу процесу, але і викликає водневу крихкість осаду, обумовлює утворення губчатих чи порошкоподібних опадів, пітингу й інших дефектів. Якщо потенціал металу, наприклад, міді в сірчанокислих електролітах значно позитивніше потенціалу виділення водню, то він не виділяється навіть при значній концентрації кислоти.
Такі метали як Zn, Pb, Sn, що мають велику перенапругу, виділяються із сірчанокислих електролітів на катоді з виходом по струму, близьким до теоретичного. У той же час метали групи заліза, на яких перенапруга водню порівняно невелика, дуже чуттєві до концентрації іонів водню.
Іони водню беруть участь у переносі струму і впливають на зміну в приелектроній зоні. Якщо кількість іонів водню, дифузюючих з об’єму і переносимі струмом в одиницю часу, менше кількості іонів водню, що розряджаються, то pH прикатодного шару буде зростати в порівнянні з його значенням в обсязі електроліту, при зворотному співвідношенні швидкостей переносу і розряду буде спостерігатися зниження pH. Зміна pH прикатодного шару спричиняє процес дифузії, що прагне зрівняти активність іонів водню в об’єму розчину і прикатодному шарі. Ця різниця в pH прикатодного шару й об’єму зі збільшенням щільності струму буде зростати. У розчинах кислот підлужування може йти тільки до pH =7.
У розчинах лугів підлужування прикатодного шару нічим не обмежено.
У випадку ж утворення важко розчинних з'єднань (гідратів чи основних солей) граничне значення pH прикатодного шару буде відповідати pH цих з'єднань.
Вимір pH прикатодного шару можна здійснювати: відбором проб електроліту з прикатодного шару методом індикаторів, методом метал-водневого електрода, скляним мікроелектродом.
Підвищення температури, перемішування і висока концентрація іонів основного металу перешкоджають підлужуванню розчину в прикатодному шарі. Як уже говорилося, частина водню впроваджується в осад. Фактори, що впливають на величину водню, що впроваджується, такі:
1) Збільшення щільності струму зменшує кількість H2 в осаді.
2) Чим більше pH, тим менше водню поглинається осадом.
3) З підвищенням температури зменшується зміст водню в осаді.
4) Перемішування електроліту сприяє зменшенню змісту водню в осаді.
5) Розчинність у металі водню залежить від природи металу.
6) Для того самого металу кількість поглиненого водню залежить від аніона, з яким зв'язаний іон металу, що осаджується.
Ці положення варто доповнити властивостями матеріалу катода і величиною водневої перенапруги на ньому. Так, наприклад, свинець і олово навіть із сильно кислих електролітів практично виділяються з 100%-м виходом по струму унаслідок високої напруги водню на них (~1,3В). Зміст водню в опадах Fe, Cu, Nі, перенапруга яких всього 0,5-0,75В складає ~ 0,1%. Видалити його можна або нагріванням у вакуумних печах при t=500-600°C протягом 2-3 годин, або нагріванням в інертній атмосфері при 170-240°С в перебігу 24 годин.
Іноді водень затримується на поверхні катода у виді пухирців. У цих місцях розряд металу стає неможливим. Вони розряджаються навколо пухирців. Осад унаслідок цього стає ніздрявим, у ньому виявляються порожнечі, що іноді пронизують усю його товщу. Такий осад вважаються браком. Це явище називається "пітингом", воно найчастіше спостерігається при нікелюванні.
Здатність газових пухирців залежить від крайового кута змочування катодної поверхні водою.
Якщо метал добре змочується водою, то пухирець сидить на маленькій основі, периметр його зіткнення з поверхнею катода малий і він легко відривається (І).
Якщо крайовий кут великий, наприклад θ=75°, то периметр дотику його з поверхнею катода, а значить і сила утримуюча його F=δl більше, тому до моменту відриву він може вирости до великих розмірів.
При досить великій катодній поляризації кут змочування θ убуває, разом з ним зменшується прилипання. При збільшенні щільності заряду катода змочування його водою  збільшується, і вода як би виштовхує пухирці з поверхні. Найбільший θ виходить, коли заряд = 0. Тому якщо процес йде при потенціалі близьким до 0, то крайовий кут θ великий, що відриваються пухирці досягають великих розмірів.
збільшується, і вода як би виштовхує пухирці з поверхні. Найбільший θ виходить, коли заряд = 0. Тому якщо процес йде при потенціалі близьким до 0, то крайовий кут θ великий, що відриваються пухирці досягають великих розмірів.
Додавання поверхневе активних речовин (ПАР) може як збільшити, так і зменшити крайовий кут. Для боротьби з пітингом часто використовують миючі засоби, наприклад, порошок "Прогрес".
Лекція 18. Розсіювання електроліту. Призначення гальвано-
покриттів.
18.1. Здатність електроліту розсіюватись.
Важливим фактором, що визначає якість гальванопокриттів, є рівномірність розподілу його по поверхні виробу. Розрахунок товщини покриття за законом Фарадея дає лише середнє значення товщини. Досвід показує, що навіть на плоских катодах, що знаходяться на однакових відстанях від анодів, щільність струму і товщина покриття розподіляються нерівномірно. На кутах і краях щільність струму значно більше розрахункової, а на середній частині катодів відповідно менше.
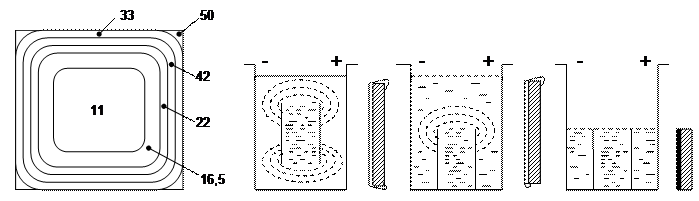
|
|
Рис.18.2
Ще в більшому ступені нерівномірність розподілу струму спостерігається при покритті профільованих виробів, у яких маються значні виступи і поглиблення. Так робити цинкування і кадміювання сильнопрофільованих виробів використовуючи кислі електроліти практично неможливо через складність одержання на них рівномірних покрить.

 На різних ділянках профільованих виробів буде різний опір між анодом і різними катодними ділянками - ближніми і далекими, а виходить, різною буде і щільність струму на цих ділянках. На ближній до анода ділянці катода осяде більше металу, а на далекій менше. Разом з тим практикою встановлено, що в ряді випадків товщини металу, обмірювані на різних ділянках складнопрофільованого катода, рівновіддалених від анода, не пропорційні відстаням.
На різних ділянках профільованих виробів буде різний опір між анодом і різними катодними ділянками - ближніми і далекими, а виходить, різною буде і щільність струму на цих ділянках. На ближній до анода ділянці катода осяде більше металу, а на далекій менше. Разом з тим практикою встановлено, що в ряді випадків товщини металу, обмірювані на різних ділянках складнопрофільованого катода, рівновіддалених від анода, не пропорційні відстаням.
Якщо взяти металеву кульку d=50мм і помістити її замість катода в золотий ціаністий електроліт на відстані 150мм від плоского катода, то в процесі електролізу, він весь покриється золотом, причому товщина покриття у віддалених і більш близьких до анода місцях кульки буде однаковою. Ця здатність електроліту вирівнювати товщину покриття в далеких і ближніх місцях катода називається розсіювальною здатністю електроліту.
На здатність розсіюватись впливають багато факторів: природа електроліту, температура і питомий електричний опір розчину, геометричні розміри і форма ванни й електродів. Всі електроліти, що мають у своєму складі комплексні солі (наприклад ціаністі), володіють гарною здатністю розсіюватись, а електроліти складені з простих солей (Cu, Zn, Nі - сірчанокислі) електроліти, мають більш низьку здатність розсіюватись.
На здатність розсіюватись впливає падіння потенціалу на границі електроліт-катодна поверхня. Унаслідок більшої поляризації на опуклих ділянках з підвищеною щільністю струму, у порівнянні з більш видаленими від анода заглибленими ділянками, де катодна поляризація менше, іонам металу стає сутужніше пробитися до опуклих ділянок катода і вони змушені переходити до увігнутого. Частина струму відволікається від опуклих ділянок і розподіляється на ділянках з меншою катодною поляризацією. Ступінь зміни початкового розподілу струму залежить від ступеня поляризації.Таким чином, при електролізі відбувається перерозподіл струму убік великої рівномірності, у порівнянні з тим розподілом, що відповідає відстані різних катодних ділянок від анода.
Рівномірність розподілу металу по поверхні катода залежить від характеру щільності струму, а значить і виходу по струму.
Ступінь перерозподілу струму і металу при електролізі убік більшої рівномірності називається розсіювальною здатністю електроліту.
Зовсім рівномірний розподіл струму на всіх ділянках поверхні, що покривається, можливий тільки у виняткових випадках, наприклад, на концентричному циліндрі, де електроди розміщаються один в одному чи на плоских довгих паралельних електродах.
На рівномірність розподілу металу впливають деякі добавки неорганічних з'єднань, наприклад, нейтральні солі лужних металів, а також колоiднi і поверхнево-активні речовини. Для більш рівномірного розподілу металу варто застосовувати тим меншу щільність струму, чим складніше форма виробів, що покриваються. Температура може позначатися по-різному і встановлювати її можна дослідним шляхом. Якщо домогтися гарної розсіюваності неможливо, тоді застосовують наступні прийоми:
1. Анодам додають форми виробів, що покриваються;
2. Збільшують відстань між анодом і виробом, що покривається;
3. Застосовують додаткові катоди для відволікання на них надлишкового струму;
4. Використовують непровідні екрани.
 По методу Херинга і Блюма здатність, що розсіює, визначається відношенням приросту ваги металу на двох катодах, що знаходяться на різній відстані від анода. Для цієї мети застосуються
По методу Херинга і Блюма здатність, що розсіює, визначається відношенням приросту ваги металу на двох катодах, що знаходяться на різній відстані від анода. Для цієї мети застосуються
Рис.18.3
прямокутна ванна, в обох кінцях якої встановлюються нерухомі катоди, що включаються паралельно, а рухливий сітчастий анод розташовується між ними так, щоб відстань від нього до одного з катодів у 5 разів перевищувало відстань до іншого катода.
 Т- здатність розсіюватись в %;
Т- здатність розсіюватись в %; 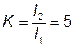 - відношення відстані між електродами;
- відношення відстані між електродами;
Мб – кількість металу, що виділився на ближньому катоді; Мд – кількість металу, що виділився на дальньому катоді;
18.2. Призначення гальванічних покрить та їхні види.
Вибір покрить, а також їхня товщина залежить від умов служби виробів. Їхня товщина регламентується ДСТами і приводиться в табл. 18.1
Таблиця 18.1
| Призначення покриття | Метал основи | Метал покриття | Товщина покриття, мкм |
| 1. Захист від атмосферної корозії | сталь | цинк | 3 - 35 |
| 2. Захист від морської води і від атмосфери насиченої морськими випарами | -//- | кадмій | 7 - 50 |
| 3. Захист від сірчаної кислоти, її солей і сірчистих з'єднань | -//- | свинець | 30 - 1000 |
| 4. Захист консервної тари і покриття під пайку | -//- | олово | 1,5 - 5,0 |
| 5. Захист від дії органічних кислот (кухонні і їдальні виробу) | -//- | олово | 10 - 25 |
| 6. Те ж | -//- | хром | 50 - 70 |
| 7. Захисно-декоративна обробка | сталь, мідь та її сплави | нікель | 5 - 25 |
| 8. Те ж | те ж | хром | 1 - 40 |
| 9. Те ж | сталь | Cu-Ni-Cr | 15 - 15 - сумарна товщина |
| 10. Те ж | сталь | Cu-Ni чи Ni-Cu-Ni | 15 - 45 - сумарна товщина |
| 11. Те ж | сталь, мідь та її сплави | нікель-хром | 6 - 12 - сумарна товщина |
| 12. Те ж | мідь, латунь | срібло | 5 - 20 |
| 13. Те ж | те ж | золото | 0,3 - 10 |
| 14. Покриття гартових стереотипів | гартова сталь, чугун | нікель | 10 - 100 |
| 15. Підвищення опору зносу | те ж | хром | 3 - 500 |
| 16. Відновлення зношених деталей і підвищення зносостійкості | те ж | залізо | 10 - 2000 |
| 17. Захист від насичення вуглецем при цементації | сталь | мідь | 20 - 40 |
| 18. Гальванопластика | Cu, Al | мідь | 250 - 2000 |
| 19. Поліпшення антифрикційних і оптичних властивостей | сталь, мідь та її сплави | індій | 0,3 - 3 |
| 20. Поліпшення антифрикційних властивостей і покриття під пайку | -//- | сплав олова і свинцю | 10 - 100 |
| 21. Поліпшення зчеплення гуми при гарячому пресуванні | -//- | латунь | 3 - 5 |
| 22. Зменшення поверхні електричного опору | -//- | срібло | 5 - 20 |
| 23. Підвищення відбивної здатності | -//- | Cu, Ni, Cr | 15 - 20 |
| 24. Те ж | -//- | срібло | 10 - 20 |
| 25. Підвищення зносостійкості і відбивної здатності | -//- | родій | 0,1 - 0,15 |
| 26. Захист від корозії точних приладів | мідь та її сплави | палладій | 2 - 6 |
| 27. Те ж | -//- | золото | 10 - 20 |
18.3Види покрить та їхнє позначення.
У залежності від способу одержання прийняті наступні умовні позначки покрить.
Ан - анодне оксидування;
Х iм - хімічний спосіб;
Гор - гарячий спосіб;
Диф - дифузійний спосіб;
Мет - металізаційний спосіб;
Кон - конденсаційний (вакуумний) спосіб;
Кт - контактний спосіб;
Кт - контактно-механічний спосіб;
Вж - впалювання;
Кр - катодне розпилення;
Эм - емалювання;
Пк - плакування;
Умовні позначки специфічних видів покрить.
тв - тверде
зн - зносостійке
шр – шорсткувате
еiз - електроізоляційне
е - електропровідне
сс - світлостійке
пор - пористе
мр - макропористе
мс - мікропористе
Умовні підвиди декоративних видів покрить.
|
зк- дзеркальне
б - блискуче
пб - напівблискуче
м - матове
Позначення матеріалів покрить.
А – Al Ko – Co Pд – Rh
Bи – Вi Mц – Mn С – Pb
В – Ж M – Cu Ср – Ag
Ж – Fe Mo – Mo Су – Sb
Зл – Au H – Ni X – Cr
Кд – Cd O – Si Ц – ZnПд – Pd пі – Pt
18.4. Анодні і катодні покриття.
Механізм захисту сталі й інших сплавів заліза від корозії у різних покрить різний.
Як приклад можна розглянути покриття цинку на залізі, що наноситься як антикорозійне. Якщо на якійсь ділянці покриття буде ушкоджено, то при наявності вологи в місці ушкодження утвориться пів осадженнямй гальванічний елемент чи, інакше кажучи, гальванічна пара. Обидва електроди Zn-Fe у цьому випадку з’єднуються не через дріт, а пів осредньо закоротко, а електролітом служить вода, що містить іони водню H+ і гідроксильні іони OH-.
У цій гальванічній парі цинк буде розчинятися, а на залізі будуть розряджатися іони водню, при цьому залізо розчинятися не буде. Тому що в цій парі цинк грає роль анода, то такі покриття називаються анодними.
Іншим прикладом може служити покриття Sn на Fe. Так як потенціал заліза є більш електронегативний ніж потенціал олова, то у випадку утворення гальванічної пари Fe-Sn, залізо буде відігравати роль анода, а олово – катода. Залізо буде розчинятися, а на олові будуть розряджатися іони водню. У такий спосіб у випадку руйнування олов’яного покриття залізо буде ржавіти. Такі покриття, у яких захисний метал, у випадку виникнення гальванічної пари, грає роль катода, називаються катодними. У катодних покрить потенціал більш позитивний чим у металу, що захищається.
Однак розподіл на анодні і катодні покриття залежить від умов. Так в умовах атмосфери чи водяних розчинах неорганічних з’єднань олово стосовно заліза є катодним, а в присутності органічних сполук воно відіграє роль анодного покриття.
Більш надійними є анодні покриття (Zn і частково Cd), а у випадку катодних (Сu, Nі, Cr, Sn, Pb, Ag, Au) в атмосферних умовах плівка їхня повинна бути суцільною. Але навіть надійні Zn покриття, що широко застосовуються в середніх географічних широтах, виявляються нестійкими в тропічному кліматі. Причиною цього є інтенсивне розчинення і змивання водою і вологою повітря шару солей цинку, що утворяться на поверхні цинку при корозії. Відбувається оголення глибинних шарів металу, і швидкість корозії не сповільнюється.
Крім цього Zn втрачає свої захисні властивості при температурі води 70° - 80°С. Потенціал цинку при цих температурах значно зростає.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 650; Нарушение авторских прав?; Мы поможем в написании вашей работы!