
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Номенклатура неорганических соединений
|
|
|
|
Систематическое название неорганического соединения читается справа налево по изображенной формуле, записанной по определенным правилам, согласно которым на первое место всегда ставится электроположительная, а на второе – электроотрицательная составляющая.
В бинарных соединениях неметаллов на первое место ставится тот элемент, символ которого стоит раньше в следующем ряду:
| Rn, Xe, Kr, B, Si, C, Sb, As, P, N, H, Te, Se, S, At, I, Br, Cl, O, F; |
например, XeF4, NH3, H2O, Cl2O, OF2, IF7, SO2, NO, B2O3.
В соединениях металлов друг с другом (интерметаллидах) символы элементов указываются в порядке роста электроотрицательности: FeNi3, MgZn, Al4Cu9.
Количество одинаковых атомов или атомных групп в формуле указывается арабскими цифрами в виде правого нижнего индекса в круглых, квадратных или фигурных *) скобках; нормальный порядок для скобок – {[()]}:
| Cr2(SO4)3, Ca3(PO4)2, La2(C2O4)3, [Cr(H2O)6]Cl3. |
В кристаллогидратах число молекул воды указывается арабскими цифрами:
| La2(C2O4)3∙10H2O, Na2SO4∙10 H2O, CuSO4∙5H2O. |
*) Фигурные скобки обычно используются в формулах координационных соединений, поскольку комплексный ион или нейтральное координационное соединение непременно заключается в квадратные скобки; рекомендуемый порядок скобок [()], [{()}], [{[()]}], например,
| [Co(NH3)6]Cl3, [Zn{NH2–CH2CH(NH2)CH2NH2}2]SO4. |
Одноатомные катионы называют по русскому названию элемента в родительном падеже и указанием степени окисления в скобках в виде арабской (+n) или римской цифры: Au+ – катион золота (+I), Au3+ – катион золота (+III), P5+ – катион фосфора (+V).
Указание степени окисления опускают, если возможен только один катион: K+ – катион калия, Ba2+ – катион бария.
Сложные катионы, образованные присоединением протона к нейтральной молекуле, называются с прибавлением окончания «-оний» или «-ий»: H3O+– катион оксония (оксоний), NH4+– катион аммония (аммоний), C5H5NH+– катион пиридиния (пиридиний).
|
|
|
Сложные катионы многозарядных ионов металлов, содержащие кислород, называются с прибавлением окончания «-ил» к корню русского названия элемента: UO22+ – уранил, MoO22+ – молибденил, VO2+ – ванадил.
Анионы, состоящие из одного атома или нескольких одинаковых атомов, называют по элементу с окончанием «-ид»: H- – гидрид, Cl- – хлорид, O2- – оксид, As3- – арсенид, Sb3- – антимонид, Si4–силицид, O22- – пероксид, N3- – азид.
Некоторые многоатомные анионы имеют собственное название: OH- – гидроксид, CN- – цианид, C22- – ацетиленид.
Сложные гетероатомные анионы элементов в высшей степени окисления оканчивается на «-ат» (SO42- – сульфат, NO3- – нитрат, PO43- – фосфат); окончание «-ит» указывает на более низкую степень окисления (SO32- – сульфит, NO2- – нитрит, AsO33- – арсенит).
Название соли начинается с аниона в именительном падеже с соответсвующим окончанием (-ид, -ат, -ит) и катиона в родительном падеже (NaCl – хлорид натрия, MgSO4 – сульфат магния, AgNO3 – нитрат серебра).
Неорганические соединения с полиатомными анионами называют по правилам координационных соединений. При этом характеристический (центральный) атом координирует оксо- или другие ионы, а анион всегда оканчивается на –ат независимо от степени окисления характеристического атома: MgSO4 – тетраоксосульфат магния, AgNO3 – триоксонитрат серебра, Na2S2O3 – триоксодисульфат динатрия, Na3PO4 – тетраоксофосфат тринатрия.
1.4. Законы стехиометрии
Основные законы стехиометрии, включающие законы количественных соотношений между реагирующими веществами с помощью уравнений химических реакций, вывод формул химических соединений, составляют раздел химии, называемый стехиометрией. Стехиометрия включает в себя законы Авогадро, постоянства состава, кратных отношений, Гей-Люссака, эквивалентов и сохранения массы.
|
|
|
В основу составления химических уравнений положен метод материального баланса, основанный на законе сохранения массы (М. В.Ломоносов, 1748, А.Лавуазье, 1789).
Закон сохранения массы веществ: Масса реагирующих веществ равна массе продуктов реакции.
В химической реакции число взаимодействующих атомов остается неизменным, происходит только их перегруппировка с разрушением исходных веществ. Взаимодействие водорода и кислорода с образованием воды может быть записано с помощью уравнения химической реакции

|
Коэффициенты перед формулами химических соединений называются стехиометрическими.
Закон постоянства состава (Ж. Пруст): Химическое соединение, имеющее молекулярное строение, независимо от метода получения характеризуется постоянным составом.
Такие соединения называют дальтонидами или стехиометрическими в отличие от 103асположени, состав которых зависит от способа получения. Такие соединения состоят не из молекул, а из атомов или ионов.
Закон кратных отношений (Д. Дальтон): Если два элемента образуют между собой несколько молекулярных соединений, то масса одного элемента, приходящаяся на одну и ту же массу другого, относятся между собой как небольшие целые числа.
При взаимодействии азота с кислородом образуются пять оксидов. На 1 грамм азота в образующихся молекулах приходится 0,57, 1,14, 1,71, 2,28, 2,85 грамм кислорода, что соответствует отношением 2:1, 1:1, 2:3, 1:2, 2:5 в этих оксидах; их составы N2O, NO, N2O3, NO2, N2O5.
Закон эквивалентов (И. Рихтер): В молекулярных соединениях массы составляющих их элементов относятся между собой как их эквиваленты.
Химический эквивалент – реальная или условная частица вещества, способная соединиться и заместить 1 моль атомов водорода в реакциях присоединения и замещения или принять (отдать) 1 моль электронов в окислительно-восстановительных реакциях.
Химический эквивалент
 
|
 
|
Закон простых объемных отношений (Ж. Гей-Люссак): При равных условиях объемы вступающих в реакцию газов относятся друг к другу и к объемам образующихся газообразных продуктов как небольшие целые числа.
|
|
|
Так, в реакции образования аммиака из простых веществ отношение объемов водорода, азота и аммиака составляет 3:1:2.
Закон Авогадро: В равных объемах любых газов, взятых при одинаковых условиях, содержится одинаковое число молекул.
Из закона Авогадро вытекают два следствия:
1. Одинаковое число молекул любых газов при одинаковых условиях занимают одинаковый объем.
2. Относительная плотность одного газа по другому равна отношению их молярных масс.
Число Авогадро – число частиц в моле любого вещества; NA = 6,02∙1023 моль–1.
Молярный объем – объем моля любого газа при нормальных условиях(температура 273 К, давление 101,3 кПа); равен 22,4 л∙моль–1.
Молярная масса (M) – масса одного моля вещества, численно совпадающая с относительными массами атомов, ионов, молекул, радикалов и других частиц, выраженных в г∙моль–1.
1.5. Химические реакции
Взаимодействие химических соединений записывается с помощью химических уравнений, отражающих материальный баланс всех реагирующих веществ. Это достигается с помощью стехиометрических коэффициентов перед формулами соединений:
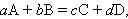
|
где A, B, C, D – реагирующие вещества; a, b, c, d – стехиометрические коэффициенты.
Можно выделить четыре основных типа химических реакций:
Соединения:
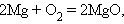
|
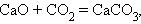
|
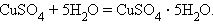
|
Замещения:
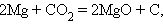
|

|
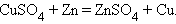
|
Разложения:
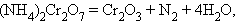
|

|

|

|
Обмена:
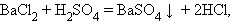
|
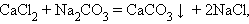
|
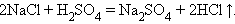
|
Реакции, сопровождающиеся изменением степени окисления всех или некоторых реагирующих веществ, называются окислительно-восстановительными. Из написанных выше реакций к таковым относятся:
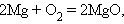
|
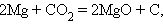
|
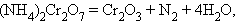
|

|
Способы получения солей
1. Взаимодействие простых веществ

|
2. Взаимодействие оксидов
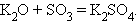
|
3. Взаимодействие кислот и оснований (нейтрализация)
|
|
|
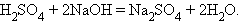
|
4. Взаимодействие соли и кислоты
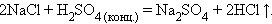
|
5. Взаимодействие соли и щелочи
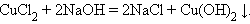
|
6. Взаимодействие двух солей (обменная реакция)
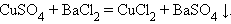
|
7. Взаимодействие оксида с кислотой
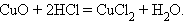
|
8. Замещение водорода
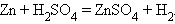
|
9. Замещение металла
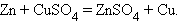
|
10. Термолиз кислых солей

|
11. Взаимодействие двух солей (присоединение)

|
12. Взаимодействие двух солей (комплексообразование)

|
Способы получения оксидов
1. Окисление простых и сложных веществ
| S + O2 = SO2; 2Mg + O2 = 2MgO, |
2.
| 2CuS +3O2 = 2CuO + 2SO2. |
3. Разложение гидроксидов

|
4. Разложение карбонатов и других солей

|
5.

|
6.
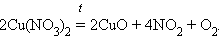
|
7. Взаимодействие металла с другим оксидом

|
Способы получения кислот
1. Взаимодействие кислотного оксида с водой
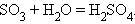
|
2. Вытеснение летучих кислот
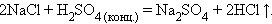
|
3. Взаимодействие соли и кислоты с образованием нерастворимой соли

|
4. Взаимодействие водорода с элементом с образованием бескислородной кислоты

|
5. Комплексные кислоты
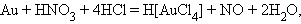
|
6.

|
Способы получения оснований
1. Взаимодействие металла с водой
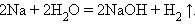
|
2. Взаимодействие оксида с водой
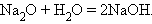
|
3. Разложение соли водой (гидролиз)

|
4. Взаимодействие соли и щелочи

|
ГЛАВА 2. ЭЛЕКТРОННОЕ СТРОЕНИЕ АТОМА
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 672; Нарушение авторских прав?; Мы поможем в написании вашей работы!