
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Водородный показатель pH
|
|
|
|
Осмос
Sp
 через моляльную концентрацию
через моляльную концентрацию 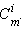 Для двухкомпонентного раствора
Для двухкомпонентного раствора 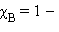
 . При
. При 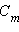 << 1 получим
<< 1 получим

|
Из подобия треугольников следует

|
По определению, при  (B) = 1 моль∙
(B) = 1 моль∙ повышение температуры
повышение температуры  равно
равно  – 103асположении103ыми103й константе для данного растворителя. Тогда повышение температуры кипения для данного раствора будет пропорционально его моляльной концентрации:
– 103асположении103ыми103й константе для данного растворителя. Тогда повышение температуры кипения для данного раствора будет пропорционально его моляльной концентрации:

|
Проведя аналогичное исследование, касающееся понижения температуры замерзания раствора, получим

|
где Kкр – криоскопическая константа.
Второй закон Рауля – понижение температуры кипения и повышение температуры замерзания раствора прямо пропорционально моляльной концентрации раствора:

|
Второй закон Рауля дает легко осуществимую экспериментально возможность определения молекулярных масс некоторых молекулярных соединений, неспособных к диссоциации в данном растворителе. Действительно, моляльная концентрация растворенного вещества может быть представлена в виде соотношения Cm = gB ∙ 1000 / μB ∙gA, где gA – вес растворителя, gB – вес растворенного вещества, μB – его молярная масса. Тогда из ΔT = Kкр · m получим молярную массу растворенного вещества:

| ||||
Если система, разделенная мембраной, представляет собой растворы, в которых через мембрану способны проходить только молекулы растворителя, то свойства ее будут определяться разностью мольных долей (концентраций) растворителя по обе стороны мембраны.
Явление, связанное со способностью проходить через мембрану, в частности, только молекул растворителя, называется осмосом, а вызываемое им изменение давления по обе стороны мембраны – осмотическим давлением. Явление осмоса чрезвычайно разнообразно и во многом определяется природой мембраны и компонентов раствора.
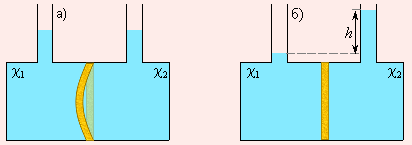
Представим, что сосуд с двумя горлами для залива раствора разделен мембраной M (рис. 6.4). В каждую часть сосуда зальем растворы, отличающиеся только концентрацией. Поскольку мольные доли растворителя по обе стороны мембраны не совпадают, то стремление их к выравниванию приведет к переходу части растворителя в ту часть сосуда, где концентрация растворенного вещества больше. Увеличение количества растворителя эквивалентно возрастанию давления, и если мембрана способна к деформации, она изогнется в сторону с меньшей концентрацией растворенного вещества (рис. 6.4а).
Если мембрана жесткая, то в отсеке с большей концентрацией количество растворителя будет возрастать до тех пор, пока гидростатическое давление h (рис. 6.4б) не станет равным осмотическому давлению и не прекратит осмос.
|
| Рисунок 6.4. Схема разности осмотических давлений при χ1 < χ2 при эластичной (а) и жесткой (б) мембранах. |
Осмотическое давление π – внутреннее давление растворенного вещества, численно равное тому внешнему давлению, которое нужно приложить, чтобы прекратить осмос; оно зависит от температуры и концентрации.
Эту зависимость Вант-Гофф уподобил поведению идеального газа:

|
По Вант-Гоффу осмотическое давление раствора численно равно тому газовому давлению, которое имело бы растворенное вещество, будучи переведенным в газообразное состояние в том же объеме и при той же температуре. Поскольку объем (разбавление) обратно пропорционален концентрации, то закон Вант-Гоффа можно записать в виде

|
Так как объем одного моля газообразного вещества при нормальных условиях равен 22,4 литра, то осмотическое давление раствора, содержащего 1 моль вещества, равно 22,4 атм.
Измерение осмотического давления раствора используется для определения молекулярных масс даже разбавленных растворов, что позволяет оценивать молекулярные массы растворимых высокомолекулярных соединений, в частности, биополимеров. Заменив C(B) в формуле Вант-Гоффа соотношением (m(B) ∙ 1000 / μ(B) ∙ V), получим уравнение, позволяющее вычислять молекулярные массы растворенных веществ:

|
m(B) – масса растворенного вещества, V – объем раствора.
Если растворы характеризуются одинаковыми осмотическими давлениями, то по Вант-Гоффу такие растворы называются изотоническими. Независимо от природы растворенного вещества, изотоничность является следствием одинакового числа частиц в растворе.
Поскольку при растворении реальное число частиц может отличаться от числа растворенных молекул, Вант-Гофф ввел понятие изотонического коэффициента i. По определению это отношение числа всех частиц к числу растворенных молекул:

| (6.1) |
В бензольном растворе уксусной кислоты i < 1, ибо в этом растворе число частиц меньше числа молекул, в результате реакции ассоциации в соответствие с уравнением
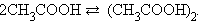
|
Если же в растворе преобладает не ассоциативный, а диссоциативный или ионизационный механизмы взаимодействия, то i > 1. Так, в водном растворе уксусная кислота диссоциирует CH3COOH = CH3COO– + H+, и число частиц становится больше числа молекул.
6.4. Растворы слабых электролитов
Растворение некоторых веществ сопровождается высвобождением или образованием ионов. При этом возможны диссоциативный и ионизационный механизмы. Диссоциативный механизм превалирует при разрушении ионной кристаллической решетки под воздействием сольватирующего растворителя. Так, ионы, составляющие кристаллическую решетку KCl, приобретают способность проводить электрический ток в любом из двух случаев разрушения кристаллической решетки – под воздействием тепловой энергии (расплав) или под воздействием сольватирующего растворителя (растворение). В последнем случае в раствор переходят готовые ионы, окруженные молекулами растворителя. Процесс взаимодействия ионов кристаллической решетки с молекулами растворителя называется сольватацией.
Ионизационный механизм состоит в том, что в молекулах газообразных, твердых и жидких веществ под воздействием полярных молекул растворителя увеличивается доля ионности настолько, что в раствор могут переходить сольватированные ионы. В зависимости от природы растворителя электролит может быть полностью диссоциирован, либо будет вести себя как слабый электролит:

|
В воде равновесие смещено вправо и растворенный хлористый водород диссоциирован полностью. В бензоле растворенный HCl ведет себя как слабый электролит.
Важной характеристикой электролитов служит степень диссоциации α:
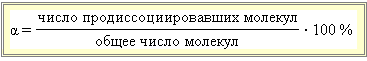
|
По величине степени диссоциации электролиты делятся на слабые и сильные. Для сильных электролитов, к которым относятся некоторые минеральные кислоты и щелочи, большинство солей, α > 30 %. К слабым относят некоторые минеральные кислоты (HNO2, HCN, H2SO3), большинство оснований, практически все органические кислоты.
Важнейшей характеристикой слабого электролита служит константа диссоциации.
Рассмотрим равновесную реакцию диссоциации слабого электролита Han:
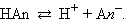
|
Константа равновесия Kc этой реакции и есть Kд:
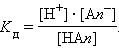
|
Если выразить равновесные концентрации через концентрацию слабого электролита C и его степень диссоциации α, то получим

|
Это соотношение называют законом разбавления Оствальда. Для очень слабых электролитов при α << 1 это уравнение упрощается:

|
Тогда

|
Это позволяет заключить, что при бесконечном разбавлении степень диссоциации α стремится к единице.
Рассмотрим диссоциацию N моль электролита, диссоциирующего на n ионов. Тогда (6.1) можно записать в виде

|
Решая его относительно α, получим
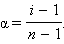
|
Определив экспериментально изотонический коэффициент, можно найти степень диссоциации α в условиях эксперимента.
Кислоты и основания диссоциируют ступенчато. Каждая ступень диссоциации характеризуется своей константой. Так, трехосновная ортофосфорная кислота H3PO4 диссоциирует следующим образом
Реакция

|
| Таблица 6.3. |
Важное значение имеет диссоциация воды, поскольку, являясь слабым электролитом и обычным растворителем, она участвует в кислотно-основном равновесии растворенных в ней электролитов.
Вода диссоциирует на ионы:

|
ее константа при 298 K равна
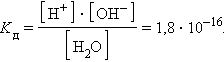
|
При столь малой константе диссоциации концентрация воды остается практически неизменной и равной

|
Отсюда произведение постоянных величин Kд∙[H2O] = [H+]∙[OH–] = const.
Численная величина произведения ионов, на которые диссоциирует вода, называемое ионным произведением воды Kв, равна

|
Таким образом, в пределах 15–25 °C ионное произведение воды Kв = 10–14.
Равенство [H+] и [OH–] соответствует нейтральной среде [H+] = [OH–] = 1 ∙ 10–7, при [H+] > 1 ∙ 10–7 – кислой, при [H+] < 1 ∙ 10–7 – щелочной.
Для определения кислотно-основных свойств раствора пользуются водородным показателем pH. По определению, это отрицательный десятичный логарифм концентрации водородных ионов: pH = –lg [H+].
Очевидно, –lg [H+][OH–] = –lg 1 ∙ 10–14 дает pH + pOH = 14.
Тогда pH < 7 указывает на кислую среду, pH > 7 соответствует щелочной среде, pH = 7 – нейтральной среде.
Поскольку pH + pOH = 14, можно видеть, что pH может меняться от небольших отрицательных значений до величин, немного превышающих 14 (pH NaOH c C = 2 равен равен 14,3).
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 473; Нарушение авторских прав?; Мы поможем в написании вашей работы!