
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гидролиз солей
|
|
|
|
В водных растворах соли полностью диссоциируют на катионы и анионы. Кроме них в растворе есть ионы H+ и OH–, образующиеся вследствие диссоциации молекул воды. Если эти ионы при взаимодействии с ионами соли образуют плохо диссоциирующие соединения, то идет гидролиз соли – разложение соли водой с образованием слабого электролита. Возможность и характер протекания гидролиза определяется природой соли:

|

|

|
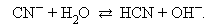
|
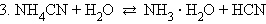
|
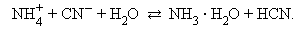
|
В первом случае гидролиз идет по катиону и pH < 7, во втором по аниону – pH > 7, а в третьем – по аниону и катиону, и величина pH в этом случае зависит от относительной силы образующихся кислоты и основания. Соли, образованные сильными основаниями и сильными кислотами, гидролизу не подвергаются.
Константа равновесия для первого случая

|
Так как [H2O] = const, то K∙ [H2O] = Kг – константа гидролиза. Тогда
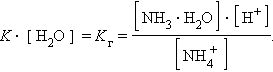
|
Умножив числитель и знаменатель на [OH–], получим

|
Аналогично для гидролиза по аниону

|
Для гидролиза по катиону и аниону одновременно
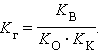
|
Связь константы гидролиза со степенью гидролиза выводится подобно закону разбавления Оствальда и записывается так:

|
C – концентрация соли в моль/л.
Для малых значений αг
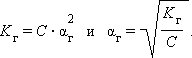
|
Для многозарядных катионов и анионов гидролиз протекает ступенчато, причем в основном по 1-й ступени.
Например, для хлорида железа (FeCl3 → Fe3+ + 3Cl–) имеем:

|
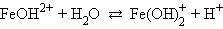
|
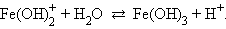
|
Распространенной ошибкой при составлении уравнений гидролиза является использование сразу более одной молекулы воды.
Сравните:
· Правильно:

|
· Неправильно:
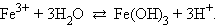
|
Гидролиз хлорида железа идет преимущественно по первой ступени из-за накапливания ионов H+ и недостатка гидроксильных ионов, необходимых для протекания реакции гидролиза ( ничтожно мала).
ничтожно мала).
В результате гидролиза многозарядных катионов образуются основные соли Fe(OH)Cl2, Fe(OH)2Cl, а гидролиз многозарядных анионов приводит к образованию кислых солей (NaHCO3, NaH2PO4).
Явление гидролиза следует учитывать при приготовлении растворов. Для предотвращения гидролиза растворы солей, подвергающиеся гидролизу по катиону, необходимо подкислять.
6.8. Произведение растворимости 
К равновесным системам следует отнести также и систему труднорастворимый электролит – его насыщенный раствор. В этом случае мы имеем дело с динамическим гетерогенным равновесием 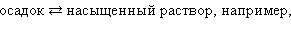

|
В этом растворе концентрация ионов очень мала и вследствие этого взаимодействие их друг с другом практически отсутствует.
Константу равновесия для гетерогенной системы можно записать так:
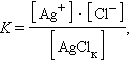
|
концентрацию твердой фазы AgClk можно считать постоянной, тогда

|
С другой стороны,

|
Так как  ,
, 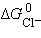 и
и 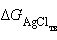 – постоянные величины, то
– постоянные величины, то

|
В общем виде для уравнения
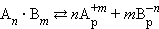
|

|
В насыщенном растворе труднорастворимого сильного электролита произведение концентрации его ионов в степенях стехиометрических коэффициентов при данной температуре есть величина постоянная, называемая произведением растворимости (ПР).
Произведение растворимости характеризует растворимость труднорастворимого электролита при данной температуре. Из двух однотипных солей, например, CaSO4 с ПР = 2,5∙10–5 и BaSO4 с ПР = 1,1∙10–10, большей растворимостью обладает та соль, у которой ПР больше.
Концентрация каждого иона в насыщенном растворе электролита может быть изменена, но при этом изменяется и концентрация другого иона так, что произведение концентраций сохраняет прежнюю величину. Поэтому, если в насыщенный раствор электролита ввести некоторое количество одного из ионов, входящих в состав электролита, то концентрация другого иона должна уменьшиться и часть растворенного электролита выпадет в осадок, то есть растворимость электролита понижается от введения в раствор одноименных ионов.
В общем виде растворимость L труднорастворимого электролита AnBm определяется соотношением
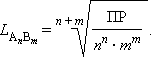
|
Изотерма Вант-Гоффа для процесса растворения

|
имеет вид

|
где  и
и  – неравновестные концентрации.
– неравновестные концентрации.
В состоянии равновесия (ΔG = 0)

|
Тогда для изотермы имеем

|
ПК – произведение концентраций ионов в степенях, соответствующих стехиометрическим коэффициентам для системы в неравновесном состоянии.
Зная ПК и сравнив его с ПР, можно установить, растворится или выпадет осадок при данной температуре:
1. Если ПК = ПР, ΔG = 0 – система находится в состоянии равновесия (раствор насыщенный).
2. Если ПК < ПР, ΔG < 0 – самопроизвольно протекает процесс растворения осадка.
3. Если ПК > ПР, ΔG > 0 – возможен только обратный процесс – выпадение осадка.
ГЛАВА 7. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1054; Нарушение авторских прав?; Мы поможем в написании вашей работы!