
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электролиз
|
|
|
|
Электролиз – это совокупность окислительно-восстановительных процессов, протекающих на электродах при пропускании постоянного электрического тока через расплав или раствор электролита. При электролизе электрическая энергия преобразуется в химическую. Ионные кристаллы относятся к диэлектрикам – электропроводностью они не обладают. Носители зарядов – ионы – занимают фиксированные положения в узлах кристаллической решетки и не имеют возможности перемещаться во внешнем электрическом поле. Расплавы и растворы электролитов характеризуются относительной свободой перемещения имеющихся в них ионов. И в том, и в другом случае кристаллическая решетка ионного кристалла разрушена: в первом случае тепловым ударом (температуры плавления неорганических соединений, как правило, превышают 1000° С), во втором случае – атакой полярных молекул воды. Если в такую систему поместить два электрода (чаще всего используют для этих целей графитовые или платиновые инертные электроды) и подать на них напряжение от источника постоянного тока, то ионы начнут перемещаться в направлении к электроду противоположной полярности: катионы – к катоду (отрицательно заряженному электроду), анионы – к аноду (положительно заряженному электроду). Далее на электродах происходит разрядка ионов –превращение их в нейтральные частицы: на аноде анионы теряют электроны, на катоде, напротив, их приобретают. Другими словами, на электродах происходят процессы:
АНОД – окисление,
КАТОД – восстановление.
При электролизе расплавов участниками этих процессов при использовании инертных электродов являются только ионы электролита. Например, электролиз расплава сульфида натрия Na2S приводит к образованию металлического натрия на катоде и свободной серы на аноде:

Если электролизу подвергается смесь электролитов, то порядок разрядки ионов определяется энергетическими критериями: в первую очередь происходят те процессы, которые требуют меньших затрат энергии. На языке электродных потенциалов это означает, что среди катионов в первую очередь восстанавливается тот, для которого величина электродного потенциала наибольшая (наименее отрицательная). Из нескольких возможных анодных процессов в первую очередь происходит процесс с наименьшим электродным потенциалом. Например, из смеси катионов Cr3+(E0 = –0.740 В), Ni2+ (Е0 = –0.250 В), Sn2+(Е0 = –0.136 В), Cu2+ (Е0 = +0.337 В) первоначально выделится медь, затем олово, далее никель и в заключение – хром.
В случае присутствия в системе различных ионов или молекул, способных к электрохимическому восстановлению или окислению, следует учитывать возможность протекания параллельных процессов. Так, при электролизе водных растворов электролитов восстанавливаться и окисляться могут молекулы воды:
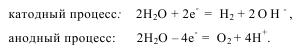
Возможность участия в электродных процессах молекул воды становится реальностью в тех случаях, когда электродные реакции с участием других частиц требуют более значительных затрат энергии. Опыт показывает, что к таковым относятся:
- катионы металлов, стоящих в таблице стандартных электродных потенциалов от Li до Al включительно (например, Li+, Rb+, K+, Cs+, Ra 2+, Ba 2+, Ca2+, Na+, Mg 2+, Al 3+);
- фторид анион F- и анионы кислородсодержащих кислот, (например, NO3-, SO42 -, CO32 -, PO43 -).
Если вернуться к рассмотренному выше примеру электролиза сульфида натрия и заменить его расплав на водный раствор, то электродные процессы изменятся следующим образом:

В этом случае выделения металлического натрия происходить не может, на катоде выделяется газообразный водород, а раствор вблизи катода подщелачивается, из него можно выделить гидроксид натрия. Анодный процесс изменений не претерпевает, так как разрядка сульфид-аниона энергетически предпочтительнее окисления молекул воды. Аналогичным образом ведут себя галогенид- и гидроксид-анионы:
2Br - - 2e- = Br2
4OH- – 4e- = O2+ 2H2O
Указанные закономерности вносят существенные ограничения в возможности практического использования электролиза водных растворов. Такие металлы, как алюминий, щелочные и щелочно-земельные металлы (величины стандартных электродных потенциалов ≤ –1.6 B), невозможно выделить электролизом водных растворов их соединений, их можно получить только электролизом расплавов. Металлы с положительными значениями E0, напротив, легко выделяются на катоде из водных растворов. Молекулы воды при этом участия в электродной реакции не принимают. Наконец, металлы, характеризуемые величинами стандартных электродных потенциалов в интервале –0.15 > E0 > –1,6 В, получаются на катоде параллельно образованию водорода в результате восстановления молекул воды. Оба процесса происходят, конкурируя друг с другом, однако преобладающим является выделение металла.
Характер анодных процессов при электролизе определяется и материалом анода. Платиновый или графитовый электроды являются инертными анодами и не подвергаются окислению. Если же анод изготовлен из металла, катионы которого находятся в растворе электролита, или из металла с меньшим значением электродного потенциала, как правило, происходит окисление материала анода. Такой электрод называют активным анодом. Например, процессы электролиза водного раствора сульфата меди с угольным (а.) и медным (в.) анодами включают следующие электродные реакции:
а) катодный процесс: Cu2+ + 2e = Cu,
анодный процесс: 2H2O – 4e = O2 + 4H+.
В) катодный процесс: Cu2+ + 2e = Cu,
анодный процесс: Cu – 2e = Cu2+.
Процесс электролиза может быть охарактеризован количественно с помощью законов Фарадея, определяющих соотношение между массой продукта, образующегося на электроде, и количеством электричества, прошедшим через электролит. Масса m или объем V (для газов) веществ, образующихся на электродах, определяются следующим выражением:

где F – константа Фарадея, 96500 Кл/моль, I – сила тока, в амперах, τ -продолжительность электролиза, в секундах, M, Vm – молярные масса и объем, в кг/моль и m3/моль соответственно), z – число электронов, участвующих в соответствующей электродной реакции.
ГЛАВА 8 КОМПЛЕКСНЫЕ (КООРДИНАЦИОННЫЕ) СОЕДИНЕНИЯ
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 2274; Нарушение авторских прав?; Мы поможем в написании вашей работы!