
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гибридные орбитали и геометрия комплексного соединения
|
|
|
|
Химическая связь в координационных соединениях
Для объяснения образования химической связи в координационных соединениях применяют несколько теорий: метод валентных связей (МВС), теория кристаллического поля (ТКП), теория поля лигандов (ТПЛ) в рамках метода молекулярных орбиталей (ММО). Ограничимся рассмотрением МВС, в основу которого положено допущение, что координационный ион (соединение) образуется по донорно-акцепторному механизму за счет неподеленных электронных пар лигандов (доноров) и свободных гибридных орбиталей иона комплексообразователя (акцептора). В образовании химической связи принимают участие гибридные орбитали иона-комплексообразователя, которые образуются при гибридизации соответствующих n s -, n p -, n d -, (n-1) d -орбиталей. При этом геометрия образующегося комплексного соединения определяется типом гибридизации и соответственно пространственным расположением гибридизованных орбиталей (таб.8.1).
Таблица 8.1
| Координацион-ное число | Связывающие гибридные орбитали | Координация |
| s | ||
| p | ||
| sp | линейная | |
| sp 2 | тригональная | |
| sp 3, sd 3 | тетраэдрическая | |
| dsp 2 | квадратно-плоскостная | |
| p 3, d 2 sp 3 | октаэдрическая |
Координационное число комплекса равно числу орбиталей, участвующих в гибридизации.
Для d -элементов гибридизация с участием d -орбиталей внешнего уровня называется внешнеорбитальной, а с участием d -орбиталей предвнешнего уровня называется внутриорбитальной. Одновременное участие в гибридизации d -орбиталей разных уровней запрещается. Внутриорбитальные комплексы более устойчивы, чем внешнеорбитальные.
Образование парамагнитного иона [FeF6]4– можно представить таким образом. Свободный ион Fe2+ имеет электронную конфигурацию d6 и следующее распределение электронов по орбиталям:
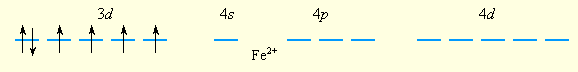
Шесть ионов F– смещают по одной из своих неподеленных электронных пар на вакантные sp3d2-гибридные орбитали иона Fe2+. Четыре неспаренных электрона иона Fe2+ сохраняются и обусловливают высокий спин и парамагнитность иона [FeF6]4–:
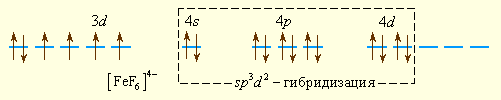
Так как число неспаренных электронов в комплексе и свободном ионе Fe2+ совпадает, то комплекс [FeF6]4– называется высокоспиновым.
Ионы CN– значительно сильнее взаимодействуют с ионом железа (II), следствием чего является спаривание d-электронов центрального иона и образование низкоспинового комплекса [Fe(CN)6]4– с d2sp3-гибридизацией, который является диамагнитным, т.к. не содержит неспаренных электронов.
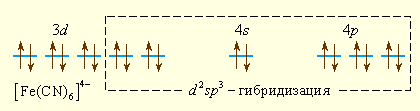
Аналогично можно представить образование и других комплексных ионов:
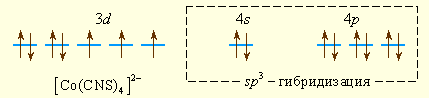
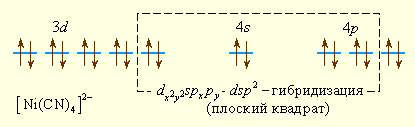
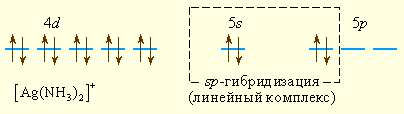
Комплексообразователем может быть не только положительный ион металла, но и металл в нулевой степени окисления, например, в карбонилах металлов – соединениях с общей формулой [M(CO)n]. Связь в таких соединениях можно объяснить с позиций МВС в рамках правила 18 электронов: устойчивы такие карбонилы, в которых все d-, s- и p-орбитали металла заполнены электронными парами. Стабильны карбонилы [Cr(CO)6], [Fe(CO)5], [Ni(CO)4]. У пентакарбонила железа [Fe(CO)5–]-d1sp3-гибридизация. Если металл имеет нечетное число электронов, то карбонилы димерны: [Mn(CO)5]2, [Co(CO)4]2.
Часто комплексные соединения d -элементов имеют видимую окраску. Как известно, окраска вещества определяется длинами волн отраженного от него света. Поглощение света комплексными ионами переходных металлов обусловлено наличием неспаренных d -электронов в этих ионах, которые поглощая световую энергию, переходят со своих основных энергетических уровней на возбужденные. Длина волны поглощаемого света, следовательно, и окраска комплекса, зависят от разности энергий этих уровней и определяется структурой комплексного иона и природой лигандов в координационной сфере. Интересно, что окраска многих драгоценных камней обусловлена наличием в них примесей ионов d -металлов.
ГЛАВА 9. ЭЛЕМЕНТЫ КОЛЛОИДНОЙ ХИМИИ
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1369; Нарушение авторских прав?; Мы поможем в написании вашей работы!