
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термодинамика негіздері
|
|
|
|
1. Термодинамика. Жүйе күйінің теңдеуі. Термодинамика әртүрлі процестердегі (жылулық, механикалық, электрлік, магниттік және т.б) молекулалалрдың жылулық қозғалысы арқылы өтетін энергия өзгеруінің сандық заңдылықтарын қарастыратын сала, яғни физикалық процестерді энергетикалық тұрғыдан қарастырады. Термодинамика денелер мен табиғат құбылыстарының тек макроскопиялық қасиеттерін ғана зерттейді.
XIX ғасырдың бірінші жартысында жылу техникасының алдында жылу машиналарының тиімділігін экономикалық жағынан арттыру мәселесі тұрды және оны шешу үшін энергияның түрлену заңын, оның ішінде жылудың механикалық энергия түріне айналдыруды тереңірек біліп, зерттеу аса қажет болды. Осы жылу техникасының талабына сәйкес термодинамика пайда болды және ол тез дами бастады.
Термодинамика адамзаттың көп жылғы еңбегінің нәтижесінде пайда болып, тәжірибе жүзінде тағайындалған екі заңынан: термодинамиканың бірінші және екінші заңы (бастамасы, сондай ақ Нернсттің жылулық теоремасына, немесе термодинамиканың үшінші заңынан (бастамасынан), құрылады. Термодинамиканың заңдары макроскопиялық жүйелердің әртүрлі жағдайдағы физикалық қасиеттерінен көптеген мәліметтер алуға мүмкіндік береді. Термодинамиканың бірінші бастамасы энергияның түрлену процестерінің сандық және сапалық жақтарын қарастырады; екінші бастамасы осы процестердің бағытын көрсетеді.
Термодинамика өзара бір-бірімен, сондай-ақ басқа да денелермен әсерлесетін және энергия алмасатын макроскопиялық денелер жиынтығы– термодинамикалық жүйені қарастырады.
Егер сыртқы жағдай күйі өзгермесе, онда термодинамикалық жүйе кез келген макроскопиялық өзгерістер тоқтағанға дейін осы жағдай күйіне келеді. Жүйенің мұндай күйі термодинаимкалық тепе теңдік деп аталады. Жүйе термодинаимкалық тепе теңдік күйінде қысым P, көлем V және температура T деп аталатын үш параметрмен сипатталады. Осы термоди-намикалық параметрлердің бір-бірінен тәуелділік теңдеуі жүйе күйінің теңдеуі деп аталатынын айтқан болатынбыз f(P,V,T)=0 (8.1)
Термодинамикалық жүйенің негізгі сипаттамасы оның ішкі энергиясы-U болып табылады. Ішкі энергия жүйенің микробөлшектерінің (молекулалар, атомдар, электрондар және т.б.) бейберекет қозғалысының кинетикалық энергиясынан, осы бөлшектердің өзара әсерлесуінің потенциалдық энергия-сынан және ішкі молекулалық энергиясынан тұрады. Денелер жүйесінің ішкі энергиясы әрбір жеке денелердің ішкі энергиялары мен денелер жанасатын жұқа қабаттағы молекулалардың арасындағы өзара әсерлесу энергиясы болып табылады.
Ішкі энергия жүйе күйінің функциясы болады. Демек, жүйе бір күйден екінші күйге өткен кезде оның ішкі энергиясының өзгерісі әрқашан да ауысу жолына тәуелсіз, яғни жүйенің бір күйден екінші күйге келтіретін процесіне немесе процестер жиынтығына тәуелсіз, тек осы күйлердегі ішкі энергияның мәндерінің айырымына тең.
Идеал газдарда молекулалардың өзара әсерлесуінің потенциалдық энергиясы нольге тең, сонда газдың бір моліне қатысты ішкі энергиясы NA молекулалардың кинетикалық энергияларының қосындысына тең болады:
Um=(i/2)kTNA=(i/2)RT (8.2)
Газдың таңдап алынған m массасы үшін ішкі энергия:
Um=(m/m)(i/2)RT =n(i/2)RT (8.3)
мұндағы m-заттың молярлық массасы, n-мольдер санын көрсететін зат мөлшері.
Ішкі энергия (U) негізінен екі түрлі процестің: дененің жұмыс A істеуі мен денеге берілген жылу мөлшерінің Q есебінен өзгереді. Бір денеден екінші денеге энергияның берілуіне әкелетін макроскопиялық процестердің жиынтығы жылу берілу деп аталады.
2. Термодинамиканың бірінші бастамасы. Сонымен, жылу берілісі мен жұмыс әрқашан да бір-біріне эквивалентті болады. Мысалы, сыртқы әсерлердің ықпалымен жүйе бір күйден (1) екінші күйге (2) көшетін болса, онда мұндай көшулердің мүмкін тәсілдерінің барлығында да сыртқы әсерлердің механикалық эквиваленттері қосындысы өзгермей тұрақты болып қалады. Сонда жүйе бір күйден екінші күйге көшкенде ішкі энергияның өзгерісі DU=U2–U1 жүйенің алған жылу мөлшері Q мен сыртқы күштерге қарсы жасалатын жұмыстың A айырымына тең:
DU=Q–A (8.4) немесе Q=DU+A (8.5)
Осы түрде жазылған өрнек термодинамиканың бірінші бастамасының математикалық теңдеуі болып табылады. (8.5) өрнекті дифференциал түрде жазатын болсақ, dQ =U+d A.
Егер жүйенің істеген жұмысын немесе алған жылуын есептеген кезде қарас-тырылып отырған процесті әдетте әрқайсысы жүйе параметрлерінің аз ғана өзгеруіне сәйкес келетін жай процестерге бөлуге тура келеді, сонда (8.5) теңдеу осындай процестер үшін мына түрде жазылады: dQ=dU+dA (8.6)
мұндағы dQ -элементар жылу мөлшері, dA -элементар жұмыс, dU -жүйенің ішкі энергиясының өсімшесі.
Берілген жылу мөлшері мен жұмыс өзара эквивалентті болғандықтан, жылу мөлшерінің де өлшем бірлігі- джоуль болады. Егер жүйе өзінің бастапқы күйіне қайтып оралса, оның энергиясы бұрынғы мәніне ие болады, яғни тұйық жүйеде ішкі энергияның өзгерісі нольге тең dU=0. Термодинамиканың бірінші бастамасына сәйкес: A=Q (8.7)
Бұдан энергияның сақталу заңын тағайындау жағынан алғанда, энергия-ның ешбір түрін жұмсамай және сырттан жылу алмай жұмыс өндіретін машина (мәңгілік двигатель) жасау мүмкін емес екендігін білеміз. Термодинамикада мұндай машина бірінші түрдегі «перпетуум мобиле» деп аталады.
3. Жылу сыйымдылық. Термодинамикада денелердің жылулық қасиетін сипаттау үшін жылу сыйымдылық ұғымы енгізіледі. Денеге берілетін немесе денеден алынатын жылу мөлшері: dQ=mcdT (8.8)
мұндағы m -дененің массасы, c -оның меншікті жылу сыйымдылығы, dT -дене температурасының өзгерісі.
Заттың меншікті жылу сыйымдылығы деп, 1 кг заттың температурасын 1К-ге қыздыру үшін қажетті жылу мөлшерінің шамасын айтады:
c=(1/m)(dQ/dT) (8.9)
Меншікті жылу сыйымдылығы Дж/(кг× К) өлшенеді.
Газдарға қатысты меншікті жылу сыйымдылығы екі түрде болады: тұрақты көлемдегі меншікті жылу сыйымдылығы СV және тұрақты қысым-дағы Cp меншікті жылу сыйымдылығы. Меншікті жылу сыйымдылықтан басқа молярлық жылу сыйымдылық та қолданылады.
Заттың молярлық жылу сыйымдылығы деп, 1 моль заттың температурасын 1К-ге қыздыру үшін қажетті жылу мөлшерінің шамасын айтады:
Сm=dQ/n dT (8.10)
мұндағы n- зат мөлшері. Өлшем бірлігі- Дж/(моль×К).
Меншікті жылу сыйымдылығының молярлық жылу сыйымдылығымен байланысы: Сm = с× m (8.11)
мұндағы m-заттың молярлық массасы. Меншікті жылу сыйымдылығының шамасы денені қыздыру шартына тәуелді: тұрақты көлемде немесе тұрақты қысымда қыздырылуына байланысты. Бірінші жағдайда газға берілген жылудың барлығы оның тек қана ішкі энергиясын арттыруға жұмсалады (газдың көлемі өзгермейтін себептен). Екінші жағдайда газдың ұлғаюына кететін жұмысқа тағы да қосымша жылу қажет болады (қысымның өзгермеуі газ көлемінің ұлғаюынан болады). Сол себепті газда екі молярлық (меншікті) жылу сыйымдылық болады: көлем тұрақты болған кездегі жылу сыйымдылық СV және қысым тұрақты болған кездегі жылу сыйымдылық CP. Осыдан CP>СV болатынын байқаймыз. Осы пікірді жете түсіну үшін термодинамиканың бірінші бастамасын бір моль газ үшін (8.6) және (8.10) формулаларды пайдаланып былай жазуға болады:
Сm dT =dUm+рdVm (8.12)
Егер қыздыру тұрақты көлем кезінде болса, онда сыртқы денелерге қарсы жұмыс жасамайтын болғандықтан р dV =0 болып, барлық жылу дененің ішкі энергиясын арттыруға жұмсалады: СV=dUm/dT (8.13)
Егер қыздыру тұрақты қысым кезінде болса, онда газ ұлғаяды да сыртқы денелерге оң жұмыс жасайды. Демек, бұл жағдайда газдың температурасын 1 К–ге арттыруға тұрақты көлем кезіндегіге қарағанда жылу көбірек керек болады дедік, сондықтан CP>СV болды, дәлірек айтқанда газдың универсал тұрақтысына R артық болады. Енді термодинамиканың бірінші бастамасы бойынша (8.12) өрнекті былайша жазайық: CP=(dUm/dT)+(рdVm/dT) (8.14) мұндағы dUm/ d T=СV. Ал Менделеев-Клапейрон теңдеуін (рV=RТ, р=Const) деп есептеп, V және T арқылы дифференциалдап, рdV=RdТ алынған мәндерді (8.14) формулаға қойсақ: CP=СV+R (8.15)
Бұл Майер теңдеуі деп аталады. Соныменен, идеал газдың 1 молінің темпе-ратурасын тұрақты қысымда 1 К-ге арттырғанда оның жасайтын жұмысы газдың универсал газ тұрақтысына тең болады: A=R. (8.16)
Сонда меншікті жылу сыйымдылығы дененің тегін сипаттайды екен.
(8.2) және (8.13) өрнектерден СV =(i/2)R (8.17) аламыз.
Майер теңдеуіне (8.17) өрнекті қоятын болсақ, CP=(i/2)R+R=(i+2)/2)R
шығады. Жылу сыйымдылықтардың қатынасын g әрпімен белгілейміз, сонда шығатын формула: g=CP/ СV =(i+2)/ i (8.18)
Мұнда g>1 және газдың түрінен тәуелді болады.
4. Термодинамиканың бірінші бастамасын изопроцестерге қолдану.
Газдың күйін сипаттайтын үш параметрдің (р,V,Т) біреуі тұрақты болып отырса, онда мұндай процестерді изопроцестер деп атайды.
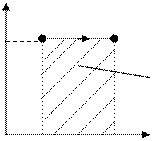
1. Изохоралық процесс. Газдың көлемі тұрақты, яғни V=Const болады, сонда dV=0, олай болса газ сыртқы күштерге қарсы жұмыс жасамайды:
d A = 1ò 2 pdV =0
 р р
р р
2 1 2
 р1
р1
А
V V1 V2 V
15 - сурет 16 – сурет
Осы процестің диаграммасын (15-сурет) салатын болсақ, 1-2 газдың изохо-ралық қыздыру процесін, ал 1-3 газдың изохоралық суыну процесін көрсе-теді. Изохоралық процес кезінде газ жұмыс жасамайды дедік, яғни d A=0.
Ендеше, жоғарыда айтылғандай, изохоралық процес үшін газға берілген барлық жылу оның ішкі энергиясын өзгертуге кетеді: dQ =dU (8.19)
(8.13) формулаға сәйкес, dUm=СVdT, сонда газдың кез келген массасы үшін
dQ =dU=(m/m)СVdT (8.20)
болады, яғни идеал газдың ішкі энергиясының өзгерісі оның абсолют температурасының өзгерісіне тура пропорционал.
2. Изобаралық процесс. Газдың қысымы тұрақты, яғни Р=Const болады, диаграммасы (16-сурет). Сонда 1-2 кесіндісі газдың изобаралық ұлғаюын
көрсетеді де, штрихталған аудан изобаралық жұмыстың шамасын анық-тайды: A=1ò 2 pdV=p (V2–V1) (8.21)
Егер газдың осы таңдап алынған екі күйі үшін Менделеев–Клапейрон тең-деуін (pV=(m/m)RT) қолданатын болсақ, онда pV1=(m/m)RT1, pV2=(m/m)RT2 , осыдан V2 –V1 =(m/m)(R/p)(T2 – T1) (8.22)
Онда изобаралық ұлғаю кезіндегі жұмыс үшін жазылған (8.21) өрнек келесі түрде жазылады: A=(m/m)R (T2 – T1) (8.23)
Осыдан молярлық газ тұрақтысының R физикалық мағынасы шығады: егер
T2–T1=1 К болса, онда газдың 1 молі үшін R=A, яғни шамасы жағынан газдың 1 молін 1 К-ге қыздыру үшін қажетті жұмысқа тең.
Изобаралық процесс кезінде массасы m газға берілген жылу мөлшері
dQ=dU=(m/m)Сp dT (8.24)
болса, онда газдың ішкі энергиясы dU= (m/m) СV dT шамаға артады. Cонда газ (8.24) формуламен есептеуге болатын жұмыс жасайды.
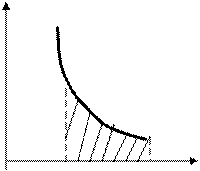
3. Изотермиялық процесс. Газдың температурасы тұрақты, яғни Т=Const болады, диаграммасы гипербола болады (17-сурет). Изотермиялық процесс Бойль–Мариотт заңымен өрнектелетінін білеміз PV=Const, изотермиялық процесс кезіндегі жұмысты анықтаймыз, оның шамасы суреттегі штрихталған ауданға тең. Менделеев–Клапейрон теңдеуінен (pV=(m/m)RT) және (8.21) өрнектен изотермиялық ұлғаю процесінің жұмы-сын анықтауға болады
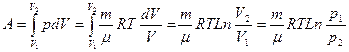 (8.25)
(8.25)
Т=Const болғанда идеал газдың ішкі энергиясы өзгермейді: dU=(m/m)СVdT=0, олай болса, термодинамиканың бірінші заңынан (dQ=dU+dA) изотермиялық процесс үшін dQ=dA (8.26) болады, яғни газға берілген жылудың барлық мөлшері оның сыртқы күштерге қарсы жа-саған жұмысына жұмсалады:
Q=A=(m/m)RTLn(р1/р2)=(m/m)RTLn(V2/V1) (8.27)
 P P
P P
 Р2
Р2
А
Р1
V1 V2 V 0 V1 V2 V
17- сурет 18- сурет
5. Адиабаталық процесс. Жүйе мен сыртқы қоршаған орта арасында жылу алмаспай өтетін процесс адиабаталық процесс деп аталады (dQ=0). Барлық тез өтетін про-цестерді адиабаталық процестерге жатқызуға болады. Мысалы дыбыстың ортада таралуын адиабаталық процеске жатқызуға болады, себебі дыбыс толқындарының таралу жылдамдығы өте жоғары болғандықтан, толқын мен орта энергиясы арасында жылу алмасу болып үлгермейді. Адибаталық процестер іштен жану двигательдерінде (цилиндрлердегі жанғыш қоспалардың ұлғаюы мен сығылуы), тоңазытқыш қондырғыларында және т.б. қолданылады. Термодинамиканың бірінші бастамасын адиабаталық процесс үшін жазатын болсақ: dA=-dU (8.28), яғни сыртқы күштердің жұмысы жүйенің ішкі энергиясының өзгерісі есебінен жасалады. (8.13) және (8.1) өрнектерді қолданып, газдың кез келген массасы үшін (8.28) теңдікті жазамыз: pdV=(m/m)CVdT (8.29)
Идеал газ күйінің теңдеуін pV=(m/m)RT дифференциалдап, келесі теңдікті аламыз: pdV+Vdp=(m/m)RdT (8.30)
Осы соңғы екі теңдіктердегі Т -ны алып тастасақ, келесі өрнек шығады:
pdV+Vdp/ pdV=R/CV = – (Cp –CV)/ CV (8.31)
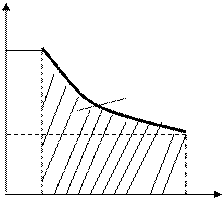
Айнымалыларды бөліп және Cp/CV=g екенін ескеріп, келесі өрнекті алуға болады: dp/p=-gdV/V, Осы теңдікті p1 -ден p2 -ге және осыған сәйкес V1 -ден V2 -ге дейінгі шектерінде интегралдап, одан кейін потенциалдасақ мынадай өрнекті аламыз: p2/p1=(V1/V2)g немесе p1V1g=p2V2g
Газдың 1 және 2 күйлері еркін таңдап алынғандықтан, pVg=Const жазуға болады. Осы алынған теңдеу адиабаталық процесс теңдеуі немесе Пуассон теңдеуі деп аталады. Мұндағы g-өлшемсіз шама, Пуассон коэффициенті деп аталады. Адиабаталық процестің диаграммасы р,V координатасында гипербола түрінде салынады (18-сурет). Суреттен байқайтынымыздай, адибата изотермаға қарағанда тіктеу келеді, себебі адиабаталық сығылу кезінде 1-3 газ қысымының ұлғаюы оның көлемінің кішіреюімен ғана емес, изотермиялық сығылудағы сияқты, температураның артуымен де байланысты.
Адиабаталық процесс кезіндегі жасалатын жұмысты есептеу үшін (8.29) теңдікті келесі түрде жазамыз dA=–(m/m)CV dT (8.32)
Егер газ көлемі V1 -ден V2 -ге дейін адиабаталық ұлғаятын болса, онда оның температурасы Т1 -ден Т2 -ге дейін кемиді және идеал газдың ұлғаю кезіндегі жұмысы A=–(m/m)CV Т2ò Т1 dT= (m/m)CV (Т1–Т2) (8.33)
Алдыңғы әдістерді қолдана отырып, адиабаталық ұлғаю үшін де жұмыстың формуласын келесі түрде түрлендіріп жазамыз.
A=(p1V1/g-1)[1-(V1 / V2)g-1]=(RT1m/(g-1)m[1-(V1 /V2)g-1] (8.34)
мұндағы p1V1=(m/m)RT1 қарастырып отырған изохоралық, изобаралық, изотермиялық және адиабаталық процестердің ортақ қасиеті–олар тұрақты жылу сыйымдылықта өтеді. Алғашқы екі процесте жылу сыйымдылықтар СV және CP, изотермиялық процесте (dТ=0) жылу сыйымдылық ±¥, адиабаталық процесте (d Q=0), жылу сыйымдылық нольге тең. Жылу сыйымдылық тұрақты болып қалатын процесс политропты процесс деп аталады.
Термодинамиканың бірінші бастамасынан жылу сыйымдылық тұрақты болған жағдайда (С=const) политропты процесс теңдеуін қорытып шығарып алуға болады PVn=const (8.35). n –политроп дәрежесі. n=(С–Ср)/(С-СV)
6. Дөңгелек процестер (цикл). Жүйе бірнеше күйден өтіп, бастапқы күйіне қайтып келетін болса, онда процесс дөңгелек процесс (немесе цикл) деп аталады. Диаграммада дөңгелек процесс тұйық сызық түрінде көрсетіледі (19-сурет). Идеал газдың циклін газдың ұлғаюы (1-2) және сығылуы (2-1) деп екіге бөлуге болады. Ұлғаю жұмысы (1а2V1V21) фигурасының ауданымен анықталады, және оң болады (dV>0). Cығылу жұмысы (2b1V1V22 фигурасының ауданымен анықталады) және теріс болады (dV<0). Газдың цикл кезінде жасайтын жұмысы тұйықталған қисықпен шектелген ауданға тең, егер осы жасалған жұмыстың мәні оң болса, онда цикл тура деп аталады (цикл сағат тілінің қозғалысымен бағыттас болады, 19-сурет), ал егер жасалған жұмыстың мәні теріс болса, онда цикл кері деп аталады (цикл сағат тіліне қарсы бағытта өтеді 20-сурет),

 Р Р
Р Р
1 1
b
a
b a 2
V1 V2 V V1 V2 V
19- сурет 20- сурет
Тура цикл периодты түрде жұмыс істейтін және ол жұмысты сырттан алатын жылу есебінен жасайтын жылу двигательдерінде қолданады.
Кері цикл периодты түрде жұмыс істейтін және сыртқы күштердің әсерінен жасалатын жұмыс есебінен жүйе жылуы температурасы жоғары денеге тасымалданатын тоңазытқыш машиналарда қолданады.
Дөңгелек процесс нәтижесінде жүйе бастапқы күйіне қайтып келетіндіктен, ішкі энергиясының толық өзгерісі нольге тең. Сондықтан да дөңгелек процесс үшін термодинамиканың бірінші бастамасы Q=DU+A (8.36) болып жазылады, яғни цикл кезінде жасалған жұмыс сыртан алған жылуға тең болады. Дегенменен, дөңгелек процесс нәтижесінде жүйе жылуды алуы да мүмкін және сыртқа беруі де мүмкін, сондықтан Q=Q1–Q2 болады. Мұндағы Q1 -жүйенің алған жылуы, Q2 -жүйенің берген жылуы. Сондықтан да дөңгелек процестер үшін термиялық пайдалы әсер коэффициенті келесі формуламен есептеледі:
h=А/Q1=(Q1 -Q2)/ Q1=1–(Q2/Q1) (8.37)
Кері бағытта өткізуге болатын процесті тура бағытта өткізгенде жүйе қандай күйлерден өтсе, кері бағытта сондай күйлер тізбегінен өтетін процесті қайтымды процесс деп атайды. Қайтымды процестерге тепе-тең процестер жатады. Осы шартты қанағаттандырмайтын, тепе-тең емес барлық нақты процестер қайтымсыз процестер болады. Кез келген тепе-тең процестер қайтымды болады.
7. Термодинамиканың екінші бастамасы. Термодинамиканың екінші бастамасы жылу машиналарының жұмыс істеу принциптерін байқаудан қалыптасты. Сондықтан осы жылу машинасының схемасын (21-сурет) қарастырайық. Сонда температурасы жоғары жылу көзінен бір циклде алынатын жылу мөлшері Q1 жұмыстық денеге беріліп жұмыс өндіреді. Ал, жылу мөлшерінің бір бөлігі Q2 суытқышқа беріліп отырады: Q2=Q1–А. Сөйтіп жылу двигателінде (қозғалтқыш) өндірілген жұмыс А=Q1–Q2. Практикалық тұрғыдан қарағанда өндірілген жұмыс қыздырғаштан алынған жылу мөлшерінің қандай бөлігі екенінің үлкен маңызы бар.


Т1 Т1
Q1 Q1
А А
Q2 Q2
Т2 Т2
21- сурет 22- сурет
Жылу машинасының термиялық пайдалы әсер коэффициенті h=1 болуы үшін Q2=0 шарты орындалуы керек, яғни берілген жылу мөлшерінің көп бөлігі жұмысқа айналса, машинаның соғұрлым тиімді болатыны анық. Сөйтіп, жылу машинасы тек қыздырғыштан алған жылу мөлшері Q1 арқылы жұмыс өндірер еді, ал бұл мүмкін емес. Француз инженері С.Карно 1824 жылы жылу машинасының жұмыс істеуі үшін міндетті түрде температурасы әртүрлі екі жылу көзі болуы керектігі дәлелденді.
Осы пікірді кейінірек 1851ж. Клаузиус пен Томсон дамытып, мынандай принцип түрінде тұжырымдады: нәтижесі бір жылу көзінен алынған жылу мөлшері есебінен тек жұмыс өндіру ғана болып табылатын периодты процесті жүзеге асыруға болмайды, яғни жылу көзінен жұмыстың денеге берілген жылу мөлшері толық жұмысқа айналатын машина жасау мүмкін емес. Бұл принцип термодинамиканың екінші бастамасы деп аталады. Осыдан туындайтын екінші түрдегі перпетуум мобиле жасау мүмкін емес.
Термодинамиканың екінші бастамасы өтіп жатқан процестің бағытын анықтайтындықтан, энергияның бір түрден екінші түрге ауыспайтынын көрсетеді.
8. Карно циклі. Термодинамиканың екінші бастамасына сүйене отырып, Карно мынандай теорема қорытып шығарды: барлық периодты түрде жұмыс істейтін жылу машиналарының ішіндегі ең тиімдісі–қыздырғыш пен суытқыштың температуралары бірдей және пайдалы әсер әсер коэффи-циенттері жоғары қайтымды машиналар. Олардың п.ә.к.-і машинаның конс-трукциясына тәуелді емес. Карно зерттеген циклдер өте тиімді, әрі үнемді тұйық процесс болып есептеледі. Бұл цикл екі изотерма және екі адиабата-дан құралатын қайтымды тұйық процесс. Циклді жүзеге асыру үшін, жұмыстық дене термиялық түрде ұлғайғанда оған тиісті мөлшерде жылу беріп тұратын қыздырғыш және жұмыстық дене изотермиялық түрде сығылғанда онан тиісті мөлшерде жылу алатын суытқыш болу қажет. Жұмыстық заттың ұлғайғанда өндіретін жұмысы оң, ал сығылғанда өндіретін жұмысы теріс болады. Жұмыстық зат ретінде идеал газдың 1 молін алып, идеал газға қатысты Карно циклін қарастырайық (22-сурет). Анықтама бойынша жылу машинасының п.ә.к.-і h=(Q1–Q2)/Q1 (8.38)
мұндағы Q1 –циклдің ішінде қыздырғыштан алынатын жылу мөлшері де, Q2 –суытқышқа берілетін жылу мөлшері.
Изотермиялық процесте идеал газдың ішкі энергиясы тұрақты болады, сондықтан жұмыстық дене (газ) 1-күйден 2-күйге көшкенде, яғни изотермиялық ұлғайғанда (1-2) орындайтын А1,2 жұмысына тең болады:
Q1=A1.2=(m/m)RT1 Ln(V2/V1) (8.39)
мұндағы m -машинадағы идеал газдың массасы. Ал адиабаталық ұлғаюда (8.23), сыртқы ортамен жылу алмасу болмай, істелген жұмыс А2,3 ішкі энергияның өзгеру есебінен пайда болады: А23=-(m/m)CV(T2–T1) (8.40)
Енді суытқышқа берілетін жылу мөлшері Q2 жұмыстық затты 3-күйден 4-күйге көшіргендегі, яғни изотермиялық сығылуға жұмсалатын А34 жұмысқа тең: - Q2=А34 =(m/m) RT1Ln(V3/V4) (8.41)
Ең соңында адиабаталық сығылу процесі (41) кезіндегі жұмыстың шамасы:
А4.1 = -(m/m)CV (T1 – T2) = - А23 (8.42)
Тұйық процесс кезінде орындалған толық жұмыс:
Атол = A12 + А23 + А3,4 + А4.1 = Q1 +А2,і - Q2 - А2,3 = Q1 - Q2
Осы Атол. 23-суреттегі штрихталған
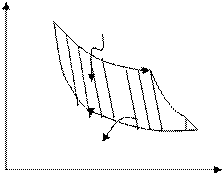 ауданға сәйкес келеді. Сөйтіп, Карно Р
ауданға сәйкес келеді. Сөйтіп, Карно Р
циклінің термиялық п.ә.к. – і (8.37) 1
өрнекке сәйкес h = A / Q1 =(Q1 - Q2)/ Q1 Q+1
шамасына тең болады. Енді адиабата- dQ=0 2
лық ұлғаю үшін (V2 /V3)g-1= T2 /T1 T1
қатынасын пайдаланып адиабаталық dQ=0
сығылу үшін (V1 /V4)g-1 = T2 /T1 деп 4 T2
жазайық. Осы екі қатынастың оң 3
жақтағы мүшелері тең болғандықтан, Q 2(-)
сол жақтары өзара тең, сондықтан:
(V2 /V3)g-1=(V1 /V4)g-1 , V2/V1 =V3/V4 (43). 23- сурет
(8.43) қатынасты (8.42)-ге және (8.40) пен (8.41) өрнектерді (8.37) теңдеуге қойсақ, п.ә.к.-і:
h=(Q1-Q2)/Q1=((m/m)RT1Ln(V2/V1)-(m/m)RT2Ln(V3/V4))/((m/m)RT2Ln(V2/V1))(44)
Сонымен, идеал газға арналған Карно циклінің п.ә.к.-і тек қыздырғыш пен суытқыш температурасына байланысты. Карноның бұл қарастырған тура циклі идеал түрдегі жылу машинасы болып табылады. Толық бір цикл өткенде газдың өндіретін жұмысы: А=Q1 –Q2=hQ1 (8.45)
Әдетте қыздырғыштың температурасы суытқыштың температурасынан әлдеқайда көбірек болса ғана п.ә.к.-нің мәні көп болады. Егер Т2=0 болса, онда h=1 болады.
Карно циклі қайтымды болғандықтан, оны керісінше жүргізуге де болады
(23-сурет). Карноның мұндай кері циклі идеал түрдегі суытқыш машина болып табылады. Оның беретін жылу мөлшерін мына формула арқылы есептеп табуға болады: Q2 = (1-h)А/h (8.46)
Сөйтіп, Карноның тұжырымдауынша термодинамиканың екінші бастамасы-на былайша анықтама беруге болады: ешуақытта суығырақ денеден ысты-ғырақ денеге жұмыс өндірілмей жылу мөлшерінің берілуі мүмкін емес.
9. Энтропия. Молекулалардың қозғалысы кезінде, олардың ретсіздікте-рін ықтималдылық теориясымен сипаттау өте тиімсіз. Сондықтан біз n бөліктен құралған жүйені қарастырайық, олардың ықтималдылық саны N1, N2, N3,..., Nn болсын. Толық жүйе үшін оның ықтималдылығы
N = N1 · N2 · N3 ·,..., · Nn
Жүйені толық сипаттау үшін оны түзетін бөліктерінің ықтималдылығының көбейтінділерін емес, олардың қосындысын аламыз. Ол үшін Больцман тағайындаған заң бойынша молекулалардың жылулық қозғалысының ретсіздік мөлшерін белгілі бір функция арқылы сипаттауға болады: S=kLnN, мұндағы: N -берілген күйдің ықтималдылығы, k-Больцман тұрақтысы, S-берілген жүйе өзгерісін сипаттайтын функция- энтропия деп аталады. Толық жүйе үшін, оның күйінің ықтималдылығы LnN=LnN1+LnN2+LnN3+…LnNn. Жүйенің энтропиясын былайша анықтаймыз: S=kLnN=kLnN1+kLnN2+kLnN3+…+kLnNn, S=S1+S2+S3+…+Sn
Егер жүйе күйінің өзгерісі тек қана бір әдіспен жүзеге асатын болса, онда оның ықтималдылығы N=1, энтропиясы S=kLnN=0 болады. Мысалға кез келген реттелген механикалық қозғалысты алуға болады. Шынында қатты дененің айналысы кезінде оның барлық молекулалары бірдей бұрыштық жылдамдықпен қозғалады.
Оқшауланған жүйеде қайтымсыз процесс кезінде жүйенің энтропиясы артады. Сонымен қатар оқшауланған жүйеде процестер энтропия артатын жаққа қарай бағытталады: DS>0 (8.38)
дербес жағдайда жүйеде өтетін процестердің барлығы да қайтымды болғанда энтропия өзгермейді DS=0 (8.39)
қарастырылып отырған процестер қайтымды болса, онда энтропия өзгермей тұрақты болады, ал қайтымсыз процестер үшін ылғи артып отырады
DS ³ 0 (8.40)
Бұл Клаузиус теңдеуі деп аталады. Енді энтропияның математикалық өрнегін жазу үшін (8.37) теңдеуді түрлендіріп жазайық:
(Q1 -Q2)/Q1=(T1-T2)/T1, 1–(Q2/Q1) =1-T2/T1 немесе Q2/Q1=T2/T1,
Q1/T1= Q2/ T2=0, мұндағы Q2 жұмыстық дененің суытқышқа беретін жылу мөлшері болғандықтан, теріс шама болып есептеледі, сондықтан:
Q1/T1+Q2/T2=0 (8.41)
Q/Т - келтірілген жылу мөлшері деп аталады. Осы келтірілген жылу мөлшері, процестегі денеге өте аз мөлшерде берілетін болса, онда оның мәні dQ/T болады.
Кез келген қайтымды тұйық процестер үшін келтірілген жылу мөлшері-нің жалпы қосындысы нольге тең болады, яғни интеграл процестің жүріп өтетін процестің жолына тәуелді болмайтындығын көреміз. сонымен энтро-пияның өзгерісін мына формула арқылы анықтаймыз Q/T=dS (8.42)
Энтропия да жүйе күйін сипаттайтын шама. Өлшем бірлігі- Дж/(моль·К)
Егер тепе-тең жағдайдағы жүйе 1-күйден 2-күйге өтетін болса, онда энтропия өзгерісі (18-сурет):
D S1®2 = S2 – S1 =1ò 2 dQ /T=1ò 2(dU+dA) /T (8.43)
яғни, бұл айырма 1-және 2-күйлердің арасында өтетін кез келген қайтымды процесте жылудың келтірілген мөлшерінің қосындысына тең болады. Жоға-рыда айтылғандай энтропияның абсолют мәнін анықтауға мүмкіндік жоқ, тек 1-және 2-күй энтропияларының (S2–S1) айырымын ғана тағайындауға болады. Жоғарыда айтылған идеал газ үшін ішкі энергияның, жұмыстың формулаларын және (8.43) формуланы қолдана отырып энтропия өзгерісі-нің формуласын жазуға болады:
DS1®2 =S2–S1=(m/m)(CVLn(T2/T1)+RLn(V2/V1) (8.44)
Сөйтіп, идеал газ энтропиясының өзгерісі DS1®2 жүйе 1–күйден 2-күйге ауысқанда, процестің өту тәртібіне тәуелді болмайды.
Оқшауланған жүйе жағдайында ол тұтас алғанда, яғни адиабаталық процесс үшін жылу алмайды да бермейді де: dQ=0, DS=0, S=Const
Сонда адиабаталық қайтымды процестер энтропия тұрақты болғанда ғана өте алады. Ал изотермиялық процестер кезінде T1=T0 болғандықтан, энтропия өзгерісі: DS=(m/m)RLn(V2/V1), ал изохоралық (V1=V2) процесс үшін энтропия өзгерісі DS=(m/m)CVLn(T2/T1)
10. Термодинамиканың үшінші бастамасы. Барлық оқшауланған жүйеде қайтымсыз процестер өткенде жүйе энтропиясы артады. Энтропия реттелмеген, ретсіз жүйе мөлшерін көрсетеді. Энтропияның абсолют мәндерін анықтау үшін оның ең болмағанда қандай да бір белгілі температура кезіндегі абсолют мәнін білуіміз керек. Энтропияның мұндай мәнін Нернст ұсынған термодинамиканың үшінші бастамасы деп аталатын теорема анықтап береді. Нернст теоремасы бойынша температура абсолют ноль болғанда қандай дененің болмасын энтропиясы нольге тең. Бұл қағи-даны былайша түсіндіруге болады. Клаузиустың ұйғаруынша, егер бүкіл әлем кеңістігін оқшауланған жүйе деп қарастырып, оған термодинамиканың екінші бастамасын қолдансақ, онда оның энтропиясы бара-бар өзінің ең жоғарғы максимум мәніне жетуі керек, сөйтіп барлық қозғалыс түрі келешекте жылуға ауысып, барлық ыстығырақ денелердің температуралары суығырақ денелерге өтіп, әлемде тепе-теңдік күй қалыптасады. Оның салда-рынан әлем кеңістігіндегі барлық процестер тоқталып, жылулық апат қаупі туады деді. XIX ғасырда айтылған осы пікірдің бір кемшілігі термодинамиканың екінші бастамасын сол кездегі кейбір оқымыстылар (идеалистер) шегі жоқ және үздіксіз қозғалыста, дамуда болатын әлем кеңістігіне қодануға болмайтынын түсінбеді. Кейінірек көптеген ғалымдар (материалистер) XIX ғасырдың аяғы мен XX ғасырдың басында бұл пікірді жоққа шығарды.
Бақылау сұрақтар

§ Молекулалардың еркіндік дәрежесі бойынша энергияның тең бөлінуі туралы Больцман заңының мағынасын түсіндіріңіз.
§ Идеал газдың ішкі энергиясы деген не? Ол қандай параметрлермен анықталады?
§ Газдың жылу сыйымдылығы деген не?
§ Сутегінің молярлық жылу сыйымдылығының температуралық тәуелділігін қалай түсіндіруге болады?
§ Адиабаталық процесс. Адиабаталық сығылу кезінде температура қалай өзгереді?
§ Тұйық жүйенің энтропиясы қандай бағытта өзгереді?
§ Карно циклін түсіндіріңіз.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 21517; Нарушение авторских прав?; Мы поможем в написании вашей работы!