
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Общие понятия. Первое начало термодинамики
|
|
|
|
ОСНОВЫ ТЕРМОДИНАМИКИ.
Лекция 12
Дополнительная
Основная
1. Грабовский Р.И. Курс физики / Р. И. Грабовский.– СПб.; Издательство «Лань», 2002.-608 с.
2. Пронин В.П. Краткий курс физики / В.П. Пронин. –Саратов: ФГОУ ВПО «Саратовский ГАУ», 2007 г. – 200 с.
3. Трофимова Т.И. Курс физики / Т.И. Трофимова. – М.: «Высшая школа». 2003 г. – 350с.
1 .Матвеев А.Н. Механика и теория относительности. Учебное пособие/ С.-Петербург: Издательство «Лань», 2009г. 500экз.
2 .Рогачев Н.М. Курс физики. Учебное пособие// С.-Петербург: Издательство «Лань», 2010г.- 448с. 1000 экз.
3 .Трофимова Т.И. Физика в таблицах.. М.: «Высшая школа». 2008г
Термодинамикой называется раздел физики, которой устанавливает связь между теплотой и др. формами энергии при различных физических и химических процессах.
Термодинамика базируется на двух фундаментальных законах и называемых началами термодинамики. Термодинамической системой тел или просто системой называется совокупность тел (напр. Система-газ, заключенный в цилиндр под поршень). Система называется Замкнутой, если она обменивается с внешней средой только энергией (космонавт в кабине косм.корабля). Открытая система обменивается с внешней средой энергией и веществом (живой организм). Изолированная, если она не взаимодействует с окружающей средой, т.к. не обменивается с ней ни веществом, ни энергией.
Эти величины характеризующие состояние системы называются параметрами состояния. Параметры изменяются при переходе системы из одного состояния в другое. Если в результате какого-либо процесса параметры стали прежними, то говорят, что система вернулась в исходное состояние. Переход системы из одного состояния в другое обусловлен процессами, происходящими внутри данной системы или в результате внешних воздействий на систему.
Термодинамическое состояние определяется совокупностью всех параметров. Не всегда какой-либо параметр имеет определенное значение. Если, например, температура в различных точках тела неодинакова, то телу нельзя приписать определенное значение температуры. В этом случае состояние называется неравновесным. Классическая термодинамика рассматривает преимущественно изолированные и замкнутые системыИзолированная система, находится в неравновесном состоянии, самопроизвольно переходит в равновесное. Время перехода называется временем релаксации.
Переход системы из одного состояния (P1V1T1) в другое (P2V2T2), происходящий через ряд промежуточных состояний называется термодинамическим процессом. (Рис.34).
 P 1
P 1

 P1V2
P1V2
 P1V1 2
P1V1 2

P2V2
 V
V
Рисунок 34
В каждом из состояний 1, 2 и I значение T и P должны быть одинаковыми, т.е. в каждом из этих состояний система должна находиться в термодинамическом равновесии. Поэтому процессы должны протекать медленно (бесконечно медленно).
Процесс, состоящий из последовательного ряда равновесных состояний, называется равновесным или квазистатическим. При достаточно медленном протекании реальные процессы могут приближаться к равновесному сколь угодно близко.
Пусть в результате процесса в изолированной системе тело переходит из состояния 1. в состояние 2. и затем возвращается в начальное состояние 1.Процесс называется обратимым, если возможно осуществить обратный переход из 2. в 1. через те же промежуточные равновесные состояния так, чтобы не осталось ни каких изменений в окружающей среде. К такому процессу можно отнести медленно протекающие процессы сжатия, расширения, нагревания и охлаждения газа.
Необратимым называется процесс, когда осуществляется переход и хотя бы одного из состояний не является равновесным и процесс нельзя провести в обратном направлении через те же промежуточные состояния. К таким процессам относятся быстро протекающие процессы сжатия, расширения, нагревания и охлаждения газа. Необратимые процессы: расширение газа в пустоту, диффузия и т.д.
Любой процесс сопровождающий трением, является необратимым. Таким образом все реальные процессы являются необратимыми.
Любая термодинамическая система обладает внутренней энергией (U). И в каждом определенном состоянии система обладает вполне определенным значением внутренней энергии т. О. внутренняя энергия является функцией состояния системы. Изменение внутренней энергии при переходе системы из одного состояния в другое всегда равно разности значений внутренней энергии в этих состояниях, и не зависит от пути, по которому совершался переход.
Изменение внутренней энергии может происходить при двух процессах:
1. Система совершает работу A против действующих на нее внешних сил и внутренняя энергия уменьшается или внешние силы совершают работу,изменяя расположение частей системы, внутренняя энергия увеличивается.
2.Система получает извне или отдает окружающей среде некоторое количество тепла Q.
Рисунок 35
Условимся считать кол-во теплоты положительным, когда оно подводится к системе, а работу положительной, когда она совершается против внешних сил.
«Количество внутренней энергии, передаваемой между полями при теплообмене называется количеством теплоты».
Рассмотрим систему: газ заключенный в цилиндр под поршнем. (Рис.35). 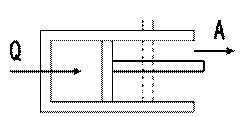
Система обладает внутренней энергией U1. Подведем некоторое количество теплоты Q. Система перейдет в другое состояние, а внутренняя энергия изменится до U2. При этом газ, расширяясь совершит работу A против внешних сил.
В соответствии с законом сохранения энергии изменения внутренней энергии будет U=U2-U1. и равно разности между количеством теплоты Q и совершенной работой A: U=Q-A или Q= U+A
Томсона и Клаузиуса, 1850г. Это первое начало термодинамики. Оно устанавливает количественные соотношения при превращении теплоты в механическую работу.(Q, U и A выражены одинаковых единицах)(джоуль).
«Количество теплоты, переданное системе, идет на увеличение ее внутренней энергии и на совершаемую системой работу против внешних сил»
Если система получает достаточно малое количество теплоты, то совершает малую работу и в системе происходит бесконечно малое изменение внутренней энергии, тогда 1-е начало термодинамики пишется в дифференциальной форме.
dQ = dU+dA
Если система термодинамики возвращается в исходное состояние то 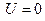 , A=Q.Тогда формулировку первому началу можно дать: «Вечный двигатель первого рода невозможен»
, A=Q.Тогда формулировку первому началу можно дать: «Вечный двигатель первого рода невозможен»
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 802; Нарушение авторских прав?; Мы поможем в написании вашей работы!