
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Влияние температуры на положение равновесия
|
|
|
|
Повышение либо понижение температуры означает приобретение либо потерю системой энергии и, следовательно, должно изменять величину константы равновесия. Для выявления зависимости константы равновесия от температуры продифференцируем уравнение изотермы химической реакции (43) по температуре:
 (43)
(43)
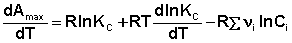 (48)
(48)
Подставим полученную производную в уравнение Гиббса-Гельмгольца:
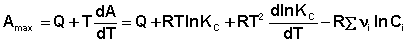 (49)
(49)
Отсюда
 (50)
(50)
После сокращения получаем уравнение, называемое изохорой Вант-Гоффа:
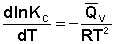 (51)
(51)
Для системы, находящейся в изобарных условиях, аналогичным образом получаем изобару химической реакции (изобару Вант-Гоффа):
 (52)
(52)
Изобара и изохора Вант-Гоффа связывают изменение константы химического равновесия с тепловым эффектом реакции в изобарных и изохорных условиях соответственно. Очевидно, что чем больше по абсолютной величине тепловой эффект химической реакции, тем сильнее влияет температура на величину константы равновесия. Если реакция не сопровождается тепловым эффектом, то константа равновесия не зависит от температуры.
Экзотермические реакции: ΔH < 0 (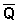 > 0). В этом случае, согласно (52), температурный коэффициент логарифма константы равновесия отрицателен. Повышение температуры уменьшает величину константы равновесия, т.е. смещает равновесие влево.
> 0). В этом случае, согласно (52), температурный коэффициент логарифма константы равновесия отрицателен. Повышение температуры уменьшает величину константы равновесия, т.е. смещает равновесие влево.
Эндотермические реакции: ΔH > 0 (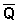 < 0). В этом случае температурный коэффициент логарифма константы равновесия положителен; повышение температуры увеличивает величину константы равновесия (смещает равновесие вправо).
< 0). В этом случае температурный коэффициент логарифма константы равновесия положителен; повышение температуры увеличивает величину константы равновесия (смещает равновесие вправо).
Схематические графики зависимостей константы равновесия от температуры для реакций с различным тепловым эффектом приведены на рисунке 1.

Рис. 1. Зависимость константы равновесия от температуры
Чтобы рассчитать изменение константы равновесия при изменении температуры, уравнение изобары (изохоры) Вант-Гоффа необходимо проинтегрировать. Если принять, что тепловой эффект реакции не зависит от температуры, что обычно справедливо в достаточно узком интервале температур, то после определённого интегрирования (51-52) получаем:
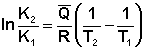 (53)
(53)
При неопределённом интегрировании изобары (изохоры) Вант-Гоффа получаем, что константа равновесия линейно зависит от обратной температуры (опять-таки при условии, что 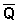 ≠ f(Т)):
≠ f(Т)):
 (54)
(54)
Действие рассмотренных нами факторов (давления, концентрации и температуры), равно как и любых других, на систему, находящуюся в состоянии химического равновесия, обобщает принцип смещения равновесия, называемый также принципом Ле Шателье – Брауна:
Если на систему, находящуюся в состоянии истинного равновесия, оказывается внешнее воздействие, то в системе возникает самопроизвольный процесс, компенсирующий данное воздействие.
Принцип Ле Шателье – Брауна является одним из следствий второго начала термодинамики и применим к любым макроскопическим системам, находящимся в состоянии истинного равновесия.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 777; Нарушение авторских прав?; Мы поможем в написании вашей работы!