
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Строение атома
|
|
|
|
Многообразие свойств металлов, в том числе различие поведения их при сварке, обусловлено во многом разницей в строении их атомов, тех элементарных комплексов, из которых построено каждое вещество. Различия в строении, энергетическом состоянии и свойствах атомов определяют разницу в характере образуемых ими элементарных агрегатов – кристаллических решеток металлов, в которых свойства оказываются уже более определенными. Колонии таких агрегатов – элементарных кристаллических ячеек – образуют кристаллы и поликристаллы, являющиеся теми металлами, с которыми имеем дело при практическом их использовании. Эти металлы имеют различную массу, пластичность и прочность, по-разному ведут себя при нагревах и охлаждениях, при сварке.
Для выяснения причин различия в свойствах металлов рассмотрим основы их физического строения, в большей части по тем характеристикам, которые могут иметь значение для сварки.
Элементарной основой элементов, в том числе металлов, является атом, состоящий из электрически положительно заряженного ядра и отрицательно заряженных электронов, вращающихся на разном расстоянии от ядра. Сумма отрицательных зарядов всех электронов атома равна положительному заряду ядра. Таким образом, в целом атом электрически нейтрален, а числовая величина заряда ядра составляет: Z·e, где e – элементарный заряд электрона, Z – число электронов. Величина Z, определяющая кратность заряда электрона элементарным зарядом, – это атомный номер элемента и одна из характеристик его свойств.
Одной из главных отличительных особенностей элементов является разница в заряде их ядра. Однако многообразие химических и физических свойств, в том числе способность атомов к соединению друг с другом, определяется разницей в электронном строении.
Электроны в атомах находятся на разном расстоянии от ядра, что определяет их энергетический уровень и прочность связи с ядром. Чем ближе находятся противоположно заряженные ядро атома и электроны, тем сильнее они притягиваются друг к другу. Кроме разного расстояния электронных оболочек от ядра, состояние электронов определяется теми орбитами, по которым они вращаются. Орбиты могут быть круговыми с ядром в центре и эллиптическими с разной степенью эллиптичности. Сама ориентировка орбит в пространстве может быть различной. Наряду с этим электрон вращается вокруг своей оси, и направление этого вращения может быть у разных электронов противоположным.
Состояние электронов в атоме характеризуется четырьмя квантовыми числами.
Главное квантовое число n характеризует энергетический уровень данной электронной оболочки по отношению к ядру. Число n может принимать целые значения от 1 до 7, что свидетельствует о возможности существования у разных элементов от 1 до 7 главных энергетических уровней. Каждому главному квантовому числу отвечает соответствующий период в периодической системе Менделеева, т.е. элементы первого периода имеют только одну основную электронную оболочку, элементы второго периода – две, третьего – три и т.д. до седьмого периода.
Число n принимает только целочисленные значения 1, 2, 3, 4, 5, 6, 7, отвечающие соответственно оболочкам K, L, M, N, O, P, Q (например, когда говорят, что электрон характеризуется значением n=4, то это означает, что он принадлежит к N-оболочке). Поскольку n входит в формулу для энергии электрона, то говорят, что главное квантовое число определяет общий запас энергии электрона в атоме.
Второе орбитальное квантовое число обозначается как l. Оно было введено, чтобы подчеркнуть неравноценность всех электронов, принадлежащих данной оболочке.
Оказывается, каждая оболочка подразделяется на определенные подоболочки, причем их число равно номеру оболочки. K-оболочка (n=1) состоит из одной подоболочки; L-оболочка (n=2) – из двух; M-оболочка (n=3) – из трех подоболочек и т.д. до 7.
Каждая подоболочка данной оболочки характеризуется определенной величиной l. Орбитальное квантовое число принимает также целочисленные значения, но начиная с нуля, т.е. 0, 1, 2, 3… Таким образом, l всегда меньше n.
При n=1 l=0; при n=2 l=0 и 1; при n=3 l=0,1,2 и т.д. Следовательно, l меняется от 0 до n–1.
Число l, если можно так выразиться, имеет геометрический образ. Ведь орбиты электронов, принадлежащих к той или иной оболочке, могут быть не только круговые, но и эллиптические.
Разные значения l и характеризуют различные типы орбит.
Для обозначения электронных подоболочек введены буквенные обозначения s (l=0), p (l=1), d (l=2), f (l=3).
Теперь можно кратко записать, какие электронные подоболочки содержатся в электронных оболочках.
Оболочки Подоболочки
K (n=1) 1s (l=0)
L (n=2) 2s (l=0) 2p (l=1)
M (n=3) 3s (l=0) 3p (l=1) 3d (l=2)
N (n=4) 4s (l=0) 4p (l=1) 4d (l=2) 4f (l=3)
Цифры у буквенных обозначений подоболочек есть главные квантовые числа. Двух квантовых чисел – главного n и орбитального l – вполне достаточно, чтобы объяснить особенности строения Периодической системы элементов на языке атомной теории при условии, если знать, сколько электронов вмещают различные электронные подоболочки. Это «сколько» нам поможет определить третье и четвертое квантовые числа – ml и ms, которые носят название магнитного и спинового.
Третье квантовое магнитное число ml тесно связано с l и определяет, с одной стороны, направление расположения орбит в пространстве, а с другой – их число, возможное для данного l. Из некоторых закономерностей атомной теории следует, что при данном l квантовое число ml принимает 2l+1 целочисленных значений: от –l до +l, включая нулевое, (например, для l=3 имеем такую последовательность ml: –3, –2, –1, 0, +1, +2, +3, т.е. всего семь значений).
Четвертое квантовое спиновое число ms определяет число электронов на каждой орбите.
Поведение атомов в сильных неоднородных магнитных полях показало, что каждый электрон в атоме ведет себя как магнитик. А это свидетельствует, что электрон вращается вокруг своей собственной оси. Это свойство электрона получило название «спин» (в переводе с англ. – вращать).
Хотя спин – общее свойство всех электронов, в нем также заключена причина различия между электронами в атоме.
Два электрона, вращаясь на одной и той же орбите вокруг ядра, обладают одним и тем же спином по величине, и все же они могут различаться направлением собственного вращения. При этом изменяется знак момента количества движения и знак спина.
Квантовый расчет приводит к двум возможным спиновым квантовым числам, присущим электрону на орбите:
 и
и 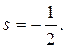
Других значений быть не может. Поэтому в атоме на каждой орбите вращается либо только один, либо два электрона.
В связи с этим можно сказать, что каждая электронная подоболочка максимально вмещает 2(2l+1) электронов, а именно:
s-подоболочка 2(2·0+1) = 2 электрона;
p-подоболочка 2(2·1+1) = 6 электронов;
d-подоболочка 2(2·2+1) = 10 электронов;
f-подоболочка 2(2·3+1) = 14 электронов.
Свойства атома и в том числе энергетические показатели связи между электронами и ядром, а также связь между собой атомов одних и тех же элементов и атомов различных элементов (что важно для соединения их сваркой) зависят от общего числа электронов в атоме, расположения их по электронным уровням, от степени заполнения (или, наоборот, от незаполненности) того или иного электронного уровня или подуровня, общего числа электронных уровней, от состояния последнего внешнего электронного уровня, от того, являются ли спины соседних электронов данного подуровня, и особенно электронов внешней оболочки, взаимно уравновешивающими или нет.
Число внешних электронов атома, т.е. электронов, находящихся на внешней оболочке (наивысшем энергетическом уровне), может быть от 1 до 8. Внешние электроны менее прочно связаны с ядром, поэтому они легче всего отделяются или отдаляются от атома. Именно эти электроны в основном ответственны за создание межатомной связи, которая определяется стремлением атома к получению завершенной электронной оболочки. Поэтому по числу внешних электронов атома определяется его валентность, и по степени достроенности внешней оболочки – его активность или способность вступать в соединение с другими атомами. Там, где внешняя оболочка полностью достроена (у гелия – это два, у остальных элементов – не менее 8 электронов), атом вещества оказывается практически пассивным к образованию связей. К таким элементам относятся инертные газы. Валентность элемента (максимальная) в Периодической системе элементов Д.И. Менделеева определяется группой, в которой он находится, что соответствует числу электронов на внешнем уровне.
Соединение отдельных атомов между собой и образование атомных комплексов обусловливает создание молекул химических соединений, образование атомных агрегатов металлов и других веществ. Способность атомов одного и того же вещества или различных веществ соединяться друг с другом в прочный агрегат – образовывать неразъемное соединение является важнейшим фактором при сварке металлов и в особенности при сварке давлением. При сварке давлением свариваемые поверхности сжимаются до сближения на расстояние, на котором могут проявиться силы атомного взаимодействия между свариваемыми поверхностями. Установление атомной связи между этими поверхностями – необходимое условие получения сварного соединения.
В настоящее время между собой сваривают металлы одни и те же (сталь – сталь, медь – медь и т.д.) и различные (сталь – никель, медь – никель и др.). Сваривают и металлы с неметаллами – керамиками.
Рассмотрение природы связи между атомами имеет первостепенное значение как для понимания условий образования различных соединений, и в том числе сварных, так и для разработки новых процессов и новых видов сварных соединений.
Атомы различных элементов отличаются между собой числом электронных оболочек – энергетических уровней, на которых расположены электроны. Чем выше энергетический уровень (чем больше квантовое число) электронной оболочки, тем дальше электроны находятся от ядра, тем выше свободная энергия электронов, тем менее прочно они связаны с ядром.
Имеет значение не только увеличение расстояния этих электронов от ядра и уменьшение силы взаимодействия между электроном и ядром, но и экранирующее влияние промежуточных электронных оболочек. Поэтому электроны внешних оболочек в атоме слабее связаны с атомом, чем все остальные электроны. Они могут при соответствующих условиях отдаляться от атома или вообще его покидать, переходя к другому атому, у которого внешняя оболочка имеет более низкий энергетический уровень и свободное место (недостроенная). Таким образом, одним из факторов, определяющих соединение атомов, является энергетическое состояние электронов на внешней оболочке (валентных электронов), чем слабее они связаны с атомом, тем легче переходят к образованию связи с другим атомом.
Прочность связи внешних электронов с атомом определяется и степенью заполненности внешней оболочки. Чем полнее заполнена внешняя оболочка, тем прочнее закреплены на ней электроны. Поэтому атомы с одним электроном на внешней оболочке легче всего его отдают.
На прочность закрепления внешнего электрона у своего атома влияет образование замкнутых магнитных полей, создаваемых спинами электронов (вращением электронов вокруг своей оси). Если у атома имеется два внешних электрона с антипараллельными спинами (вращающимися в разные стороны), т.е. имеющих четвертное квантовое число (у одного –1/2, у другого +1/2), то магнитные поля, создаваемые при вращении заряда электронов, образуют более замкнутое магнитное поле, способствующее удержанию каждого из электронов. Если на внешней орбите имеется только один электрон и нет электрона с антипараллельным спином, то этот электрон удерживается слабее, чем два электрона с противоположными спинами.
Если рассматривать соединение двух различных атомов (сварку разных металлов), то наличие на внешних оболочках атомов с противоположными спинами должно обусловливать образование уравновешенных магнитных полей и улучшение свариваемости.
Сила, с которой удерживается электрон у своего атома (речь идет о внешних электронах), определяется ионизационным потенциалом – напряжением, которое необходимо приложить, чтобы оторвать электрон и сделать атом положительно заряженным ионом. У атома может быть несколько ионизационных потенциалов (в соответствии с тем, сколько у него электронов на внешней оболочке и какой по счету электрон отрывается).
Значение первых ионизационных потенциалов различных элементов – важный показатель способности атомов к установлению межатомных связей. Наиболее высокие потенциалы ионизации имеют элементы с полностью застроенной внешней оболочкой (инертные газы). По мере уменьшения степени заполнения внешнего уровня потенциал ионизации падает. Низкие потенциалы ионизации имеют элементы с наименее застроенными оболочками. По мере увеличения атомного номера элемента сказывается экранирующее влияние внутренних электронных уровней.
Ионизационные потенциалы могут служить энергетическим показателем способности к соединению отдельных частей тех или иных металлов. При условии, что произошло сближение соединяемых частей на расстояния сил атомного взаимодействия и соединяемые поверхности чисты, для установления соответствующей атомной связи, нужна какая-то энергия для активации атомов соединяемых частей. Чем ниже потенциал ионизации атома, тем легче его сделать активным для установления связи. С этой точки зрения легче всего должен свариваться в твердом или пластичном состоянии между собой алюминий (ионизационный потенциал – 5,98 эВ), несколько труднее – титан (6,82 эВ), затем – ниобий (6,88 эВ), молибден (7,1 эВ), свинец (7,42 эВ), серебро (7,57 эВ), никель (7,63 эВ), магний (7,64 эВ), медь (7,72 эВ), железо (7,83 эВ), вольфрам (7,98 эВ). Важны не только потенциалы ионизации для сварки давлением, но и другие характеристики (в частности, возможность сближения при деформации).
Для прочности межатомной связи большое значение имеет ее тип, т.е. способ и принцип соединения атомов между собой.
Основой межатомной связи и, следовательно, образования неразъемных соединений является взаимодействие электронов, а движущей силой этого взаимодействия – стремление атомов к получению завершенных электронных оболочек и достижению наиболее устойчивого распределения электронов по уровням и подуровням. В результате различных взаимодействий между атомами может образоваться несколько типов наиболее устойчивых электронных структур. Ими оказываются структуры инертных газов и структуры, имеющие во внешней оболочке 18 электронов. Таким образом, при взаимодействии между собой атомов различных веществ каждый из них путем отдачи или захвата электронов стремится приобрести ближайшее ему устойчивое электронное строение. Атомы металлов стремятся к достижению устойчивой электронной конфигурации путем отдачи электронов.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 886; Нарушение авторских прав?; Мы поможем в написании вашей работы!