
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Атомно-кристаллическая структура металлов
|
|
|
|
Под атомно-кристаллической структурой понимают взаимное расположение атомов (ионов), существующее в реальном кристалле.
В твердом состоянии металл представляет собой соединение, состоящее из положительно заряженных ионов, омываемых «газом» из свободных коллективизированных электронов. Связь в металле осуществляется электростатическими силами. Между ионами и коллективизированными электронами проводимости возникают электростатические силы притяжения, которые стягивают ионы. Такая связь называется металлической.
Силы связи в металлах определяются силами отталкивания и силами притяжения между ионами и электронами. Атомы (ионы) располагаются на таком расстоянии один от другого, при котором энергия взаимодействия минимальна. Как видно из рисунка 1, этому положению соответствует равновесное расстояние α0. Сближение атомов (ионов) на расстояние, меньшее α0, или удаление их на расстояние, большее α0, осуществимо лишь при совершении определенной работы против сил отталкивания и притяжения.
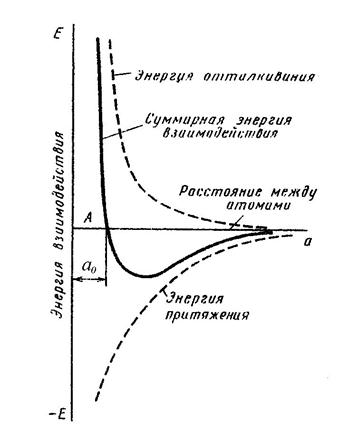
Рис. 1. Схема энергии взаимодействия двух атомов
в зависимости от межатомного расстояния
Поэтому в металле атомы располагаются закономерно, образуя правильную кристаллическую решетку, что соответствует минимальной энергии взаимодействия атомов.
Кристаллическая решетка (рис. 2) состоит из воображаемых линий и плоскостей, проходящих через точки расположения ионов в пространстве. Жирными линиями выведен наименьший параллелепипед, последовательным перемещением которого вдоль трех своих осей может быть построен весь кристалл.

Рис. 2. Схема кристаллической решетки
Этот наименьший объем кристалла, дающий представление об атомной структуре металла в любом объеме, получил название элементарной кристаллической ячейки.
Для однозначной ее характеристики необходимо знать следующие величины: три ребра (α, b и с) и три угла между осями α, β и γ (рис. 3).
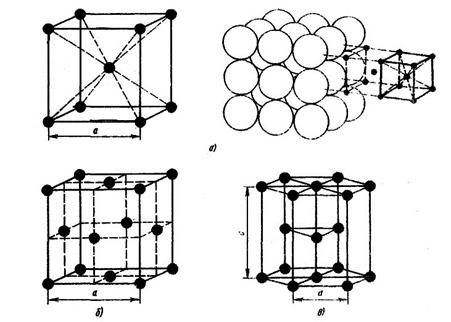
Рис. 3. Кристаллические решетки металлов: а – объемно центрированная кубическая (ОЦК);
б – гранецентрированная кубическая (ГЦК); в – гексагональная плотноупакованная (ГПУ)
Большинство металлов образует одну из следующих высокосимметричных решеток с плотной упаковкой атомов: кубическую объемно центрированную, кубическую гранецентрированную и гексагональную (рис. 3).
Как видно из рисунка 3а в кубической объемно центрированной решетке (ОЦК) атомы расположены в вершинах куба и один атом в центре объема куба. Кубическую объемно центрированную решетку имеют металлы: Рb, К, Na, Li, Tiβ, Zrβ, Та,W, V, Fеα, Сr, Nb, Ва и др.
В кубической гранецентрированной решетке (ГЦК) атомы расположены в вершинах куба и в центре каждой грани (рис. 3 б). Решетку такого типа имеют металлы: Саα, Се, Srα, Tn, Рb, Ni, Аg, Аu, Рd, Рt, Rh, Jr, Fеγ, Сu, Соα, и др.
В гексагональной решетке (рис. 3 в) атомы расположены в вершинах и центре шестигранных оснований призмы, а три атома – в средней плоскости призмы. Такую упаковку атомов имеют металлы: Мg, Tiα, Сd, Rе, Os, Ru, Zn, Соβ, Ве, Саβ и др.
Расстояния α, b, с между центрами ближайших атомов в элементарной ячейке (см. рис. 2) называются периодами решетки. Он выражается в нанометрах (1 нм = 10–9 м).
Периоды решетки для большинства металлов находятся в пределах
0,1…0,7 нм.
На одну элементарную ячейку объемно центрированной решетки приходятся два атома: один в центре куба и другой вносят атомы, располагающиеся в вершинах куба (каждый атом в вершине куба одновременно принадлежит восьми сопряженным элементарным ячейкам и на данную ячейку приходится лишь 1/8 массы этого атома, а на всю ячейку 1/8´8=1).
На элементарную ячейку гранецентрированной кубической решетки приходятся четыре атома, из них один (по такому же расчету, как и для объемно центрированной кубической решетки) вносят атомы в вершинах куба, а три суммарно [(1/2)´6=3] – атомы, находящиеся на середине грани, так как каждый из таких атомов принадлежит двум решеткам.
На элементарную ячейку гексагональной плотноупакованной решетки приходится шесть атомов (3+(1/6) ´12 +(1/2) ´ 2=6).
Плотность кристаллической решетки – объема, занятого атомами, которые условно можно рассматривать как жесткие шары (рис. 3 а), характеризуется координационным числом, под которым понимают число атомов, находящихся на равном и наименьшем расстоянии от данного атома. Чем выше координационное число, тем больше плотность упаковки атомов.
В элементарной ячейке объемно центрированной кубической решетки наименьшее расстояние между атомами соответствует 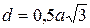 . На этом расстоянии от данного атома находятся 8 соседей (рис. 4 а). Следовательно, координационное число для ОЦК решетки соответствует 8 и обозначается К8. Коэффициент компактности ячейки, определяемый как отношение объема, занятого атомами, к объему ячейки составляет для ОЦК решетка 68 %.
. На этом расстоянии от данного атома находятся 8 соседей (рис. 4 а). Следовательно, координационное число для ОЦК решетки соответствует 8 и обозначается К8. Коэффициент компактности ячейки, определяемый как отношение объема, занятого атомами, к объему ячейки составляет для ОЦК решетка 68 %.
Для гранецентрированной кубической решетки координационное число равно 12 (К12); каждый атом имеет 12 ближайших соседей на расстоянии 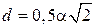 (рис. 4 б), что соответствует наибольшей плотности упаковки или укладки в виде шаров. Гексагональная плотноупакованная решетка, для которой с/α = 1,633, имеет координационное число 12 (Г12), что также соответствует наибольшей плотности упаковки шаров (атомов) (рис. 4 в).
(рис. 4 б), что соответствует наибольшей плотности упаковки или укладки в виде шаров. Гексагональная плотноупакованная решетка, для которой с/α = 1,633, имеет координационное число 12 (Г12), что также соответствует наибольшей плотности упаковки шаров (атомов) (рис. 4 в).
У многих металлов, кристаллизующихся в гексагональной системе, отношение с/α находится в пределах 1,57…1,64, т. е. может отклоняться от плотнейшей упаковки, при которой с/α=1,633. Если отношение с/α значительно отличается от 1,633 (например, для цинка и кадмия), то координационное число гексагональной решетки соответствует 6.

|
Рис. 4. Схема, показывающая число атомов, находящихся на равном
и наименьшем расстоянии от данного атома А в разных кристаллических решетках:
α) К8; б) К12; в) Г12
Гранецентрированная кубическая и гексагональная плотноупакованная
(с/α = 1,633) решетки – наиболее компактные; в них коэффициент компактности равен 74 %.
При уменьшении координационного числа в гексагональной решетке
от 12 до 6 коэффициент компактности составляет около 50 %, а при координационном числе 4 – всего около 25 %.
Половину наименьшего расстояния между атомами в их кристаллической решетке называют атомным радиусом. Атомный радиус возрастает при уменьшении координационного числа, так как при этом увеличивается пространство между атомами. Поэтому атомные радиусы разных металлов обычно приводятся к К12.
Кристаллографические обозначения атомных плоскостей. Для определения положения атомных плоскостей (проходящих через атомы) в кристаллических пространственных решетках пользуются индексами h, k, l, представляющими собой три целых рациональных числа, являющихся величинами, обратными отрезкам осей, отсекаемым данной плоскостью на осях координат. Единицы длины вдоль осей выбирают равными длине ребер элементарной ячейки. Эти числа заключают в круглые скобки.
Приведем примеры обозначения плоскостей. Установим первоначально индексы для плоскости куба. Каждая плоскость куба (на рис. 5 а) пересекает только одну ось, при этом отсекаемые отрезки будут равны (1, ∞, ∞); (∞, 1, ∞);
(∞, ∞, 1). Обратные величины отсекаемых отрезков будут соответственно равны: (1, 0, 0); (0, 1, 0); (0, 0, 1). Индексы плоскости (hkl) будут (100), (010), (001), (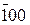 ), (
), (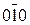 ) и (
) и ( ). Знак минус над индексом соответствует отрицательным отрезкам.
). Знак минус над индексом соответствует отрицательным отрезкам.
В кубической решетке кроме плоскостей куба (рис. 5 а) различают плоскость октаэдра (111) (рис. 5 в) и плоскость ромбического додекаэдра (110)
(рис. 5 б).
|
|
|
|
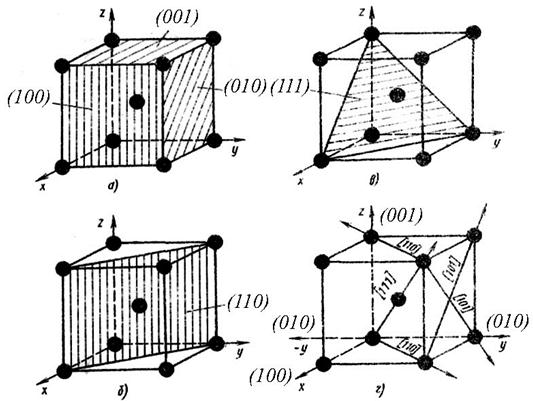
Рис. 5. Индексы кристаллографических плоскостей (а-в) и направлений (г)
в ОЦК решетке
Следует иметь в виду, что индексы характеризуют не одну какую-либо плоскость, а целую группу параллельных плоскостей, и тогда их заключают в фигурные скобки.
Индексы направлений. Для определения индексов направлений расположения рядов атомов в кристаллической решетке необходимо из семейства параллельных плоскостей выбрать направление плоскостей, проходящих через начало координат. Далее, приняв за единицу длину ребра элементарной ячейки (или период решетки), определяют координаты любой точки этого направления. Полученные значения координат точки приводят к отношению трех наименьших чисел. Эти числа, заключенные в квадратные скобки [uvw], являются индексами данного направления и всех параллельных ему направлений. Основные направления в кубической решетке приведены на рисунке 5 г, Индексы осей решетки х – [100], у – [010] и z – [001]. Индексы пространственной диагонали [111]. Для кубической решетки индексы направлений [uvw], перпендикулярных к плоскости (hrl), численно равны индексам этой плоскости. Например, индексы оси х равны [100], а индексы плоскости, перпендикулярной к оси х, равны (100).
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1484; Нарушение авторских прав?; Мы поможем в написании вашей работы!