
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Буферные процессы
|
|
|
|
Теоретические замечания
Буфер представляет собой смесь слабой кислоты с сопряженным с нею основанием. Она находится в положении, способном выравнивать («забуферивать») концентрацию ионов водорода.
Процесс «забуферивания» можно выразить математически. Выражение этих взаимодействий вытекает из следующих рассуждений.
Угольная кислота диссоциирует частично на ионы водорода и гидрокарбоната:
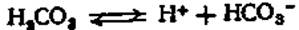
Эта диссоциация по закону действующих масс формуляру-ется следующим образом:
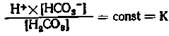
Выделяя концентрацию ионов водорода, получаем:
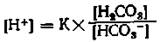
Так как (Н+) равнозначно можно представить как значение рН или как отрицательный десятичный логарифм, то далее следует:

или
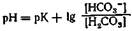
(уоавнение Henderson—Hasselbalch) Это уравнение Henderson—Hasselbalch можно выразить совершенно равнозначно:
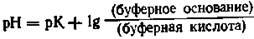
Если рК и рН равны, то буферные кислота и основание находятся в одинаковых концентрациях. Значение рН при этом является и мерой силы кислоты: чем оно ниже, тем сильнее кислота.
Примеры рК (Rausher с соавт.)
— угольная кислота 1-я ступень диссоциации 6,37 (25 °С)
— фосфорная кислота 1-я ступень диссоциации 2,12 (25 °С)
2-я ступень диссоциации 7,21 (25 °С)
3-я ступень диссоциации 12,66 (25°С)
— уксусная кислота 4,76 (25 °С)
— молочная кислота 3,86 (25 °С)
Примеры забуферивания
При голодании и диабетической коме образуются кетоновые тела (бета-гидроксимасляная и ацетоуксусная кислоты). Они тотчас диссоциируют на ионы водорода и кислотный радикал (бета-гидроксибутират и ацетоацетат). Эти распавшиеся ионы водорода вели бы к значительному повышению [H+] (снижение значения рН), если бы они не связывались с буферным основанием, например гидрокарбонатом: гидрокарбонат после присоединения ионов водорода превращается в угольную кислоту. При этом снижается концентрация гидрокарбоната. Место, свободное от анионов, занимают анионы гидрокарбоната и бета-гидроксибутират и ацетоацетат (рис. 7).
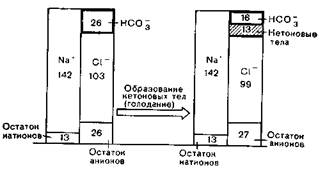
Рисэ 7. «Вытеснение бикарбоната» кетоновыми телами.
Если мы сформулируем результат этого процесса по уравнению Henderson—Hasselbalch, то получим:
рН = 6,1 + lg(16/1.2) = 6,1 + 1,12 = 7,22
Без этого буферного действия значение рН упало бы значительно ниже. Буферная система более эффективна, так как угольная кислота удаляется из организма дыханием (открытая система!):
pH = 6,l + lg(16 /0.90) = 6,1 + 1,25 = 7,35
Снижение значения рН таким образом могло выравняться, если функция легких не нарушена.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 456; Нарушение авторских прав?; Мы поможем в написании вашей работы!