
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Металлическая связь
|
|
|
|
Гибридизация орбиталей и пространственная конфигурация молекул
| Тип молекулы | Исходные орбитали атома А | Тип гибридизации | Число гибридных орбиталей атома А | Пространственная конфигурация молекулы |
| АВ2 АВ3 АВ4 | s + p s + p + p s + p + p + p | sp sp2 sp3 | линейная треугольная тетраэдрическая |
При образовании двойных, тройных связей в органических соединениях (этилен, ацетилен) происходит перекрывание р-электронных облаков в плоскостях, перпендикулярно σ-связям и образование π-связей.
Атомы большинства металлов на внешнем энергетическом уровне содержат небольшое число электронов (1, 2. 3), это в основном s- и d-элементы. В обычных условиях металлы - кристаллические вещества (кроме ртути). На рисунке представлена схема кристаллической решетки натрия.
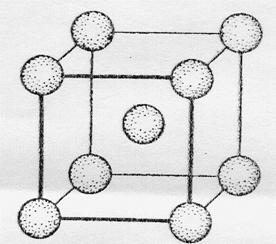
Кристаллическая решетка натрия
Как видно, каждый атом натрия окружен восемью соседними атомами. У атома натрия, как и у других металлов, имеется избыток валентных орбиталей и недостаток электронов. При сближении атомов в результате образования кристаллической решетки валентные орбитали соседних атомов перекрываются, благодаря чему электроны свободно перемещаются из одной орбитали в другую, осуществляя связь между всеми атомами кристалла металла. Такой тип химической связи называется металлической.
Между ковалентной и металлической связью имеется большое сходство – оба типа химической связи основаны на обобществлении валентных электронов. Только в металлах обобществленные электроны обслуживают весь кристалл, то есть они полностью делокализованы. Электроны, осуществляющие связь, обобществлены («электронный газ») и перемещаются по всему объему металла, в целом электронейтрального. Этим объясняется отсутствие пространственной направленности металлической связи и высокие координационные числа металлических структур. Это означает, что металлическая связь не проявляет свойств насыщаемости, столь характерных для ковалентной связи. Делокализация же валентных электронов в металлах является следствием многоцентрового характера металлической связи и причиной хорошей электро- и теплопроводности металлов, пластичности и ковкости. Для веществ с ковалентной связью при отсутствии примесей электропроводность может быть обеспечена только в результате разрушения этих связей. Объясняется это тем, что ковалентная связь соединяет только два соседних атома, а общие электроны пребывают в непосредственной близости от них и прочно с ними связаны.
Металлическая связь – многоцентровая химическая связь с дефицитом электронов, основанная на обобществлении внешних электронов атомов. Таким образом, металлическая связь характерна только для конденсированного состояния вещества. В паро- и газообразном состоянии атомы всех веществ, в том числе и металлов, связаны между собой только ковалентной связью.
Аналогия между ковалентной и металлической связями подтверждается распределением электронной плотности между атомными остовами. Для обоих типов связей в пространстве между атомными остовами сохраняется значительная электронная плотность, образуя электронные мостики между взаимодействующими атомами.
Разница заключается в том, что в ковалентной связи электронные мостики имеют строго определенное пространственное направление, а у металлической связи электронная плотность равномерно распределена по всем направлениям. В результате в решетке типичных металлов все атомы кристаллографически эквивалентны и эффективные заряды атомов равны нулю.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 437; Нарушение авторских прав?; Мы поможем в написании вашей работы!