
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ядерне паливо
|
|
|
|
В усіх енергетичних реакторах в якості палива використовують уран: або природний, що містить 0,7 % 235U, або збагачений, в якому вміст 235U підвищено до декількох відсотків. Деякі дослідні енер-гетичні реактори працюють на 232Th (в них відтворюється ізотоп 233U, що ділиться) або на 239Pu в су-міші з 238 в якості домішки до 235U („змішане паливо”).
Незалежно від того, чи використовується уран, торій або плутоній, твел повинен бути здатним витримувати температури, які значно перевищують 1000 оС, не зазнаючи фізичного або хімічного ушкодження під дією тепла або опромінення. Твели, виготовлені із металічного урану, мають високу теплопровідність, необхідну для максимального зменшення температурних ефектів, але на жаль уран плавиться при 1130 оС, а плутоній – при 640 оС. Більше того, металічний уран має три, а плутоній шість алотропних форм в діапазоні від кімнатної температури до плавління. В результаті вплив поля випромінювання і високої температури може спричинити перекристалізацію в різних алотропічних формах, що призведе до значних змін фізичних розмірів паливного стрижня. Такі деформації в твелі зменшують механічну міцність і підвищують можливість корозії, навіть якщо твели мають металеву оболонку.
В більшості енергетичних реакторів в якості палива використовують розташовані в оболонках керамічні пігулки з UО2, PuО2 або ThО2. В деяких реакторах використовують UС. Розмір цилін-дричних пігулок 1х 1 см. Такі твели термостійкі, не зазнають фазових перетворень металів і більш стійкі до радіаційних ефектів. На жаль, теплопровідність керамічних твелів нижче, ніж у металічних, тому в керамічних твелах часто виникають доволі високі температурні градієнти (до 100 оС/мм). При цьому керамічне паливо може плавитись в центрі твелу (tпл UО2 2700 оС), навіть якщо температура на поверхні твелу значно нижча температури плавління палива. Щоб забезпечити максимальну теп-лопровідність в керамічному паливному матеріалі, його спікають і пресують до щільності біля 11 г/см3 для UО2.
У випадку, коли застосовують твели із змішаного уран-плутонієвого палива, наприклад в водо-водяних (< 5 % PuO2) або швидких (≤ 15 % PuO2) реакторах, суміш UО2 - PuO2 повинна бути більш однородною в структурному відношенні і переважно бути твердим розчином. Краще за все це дося-гається сумісним осаджуванням цих чотирьохвалентних актиноїдів, звичайно у формі оксалатів, з наступним прожарюванням осаду, що отримується. Змішане паливо на основі оксидів урану і торію використовують також в реакторах на важкій воді.
Замість пігулок можна використовувати сферичні паливні частинки. Це дає переваги у виготов-ленні, використанні в реакторі і в переробці палива. Ці частинки із оксидів або карбідів дуже малень-кі, діаметром менше 1 мм. Частинки отримують методом „золь – гель”, який в принципі складається із стадій:
1. Готують водний колоїдний розчин актиноїду або суміші актиноїдів, які можуть бути у формі гідратованого комплексу високої концентрації.
2. Отриманий розчин добавляють в інертний розчинник, в результаті чого відбувається дегідрата-ція комплексу і гелеутворення. В одному із способів до водного розчину актиноїду додають гекса-етилентетрамін (CH2)6N4 і потім отриманий розчин краплями додають в гарячий (біля 95 оС) орга-нічний розчинник. Амін під дією тепла розкладається, утворюючи NH3, який викликає гідрооксидне осадження в краплі. Крапля швидно дегідратується і отверджується, утворюючи так зване „ядро”.
3. Ядра промивають, сушать в тоці повітря при 150-200 оС і, у випадку урану, відновлюють газо-подібним воднем при більш високій температурі, отримуючи UО2.
4. Ядра спікають при високій температурі в атмосфері інертного газу.
Аналогічно можна виготовляти ядра із карбідів актиноїдів. Ядра розташовують у трубках, пресу-ють в пігулки або оброблюють для використання в високотемпературних реакторах.
Металеве паливо вміщують в оболонку з алюмінію, магнію або із сплавів алюмінію та магнію, а пігулки із оксидного палива – в оболонки із сплавів цирконію і нержавіючої сталі. Призначення оболонки – захист палива від корозії та захист теплоносія від радіоактивного забруднення продук-тами поділу із твелу. В реакторах, що охолоджуються водою, використовували алюміній, а при тем-пературі вище 300 оС більш міцні цирконієві сплави. При температурах пари більше 400 оС цирко-ній поглинає водень, що підвищує його крихкість, тому переваги має нержавіюча сталь. Найбільш звичайними сплавами, що застосовуються в якості матеріалу оболонки, є циркалой-2 (містить 1,5 % Sn i 0,3 % Cr, Ni i Fe) та нержавіюча сталь марки 302 В (містить 18 % Cr i 8 % Ni). Нержавіючу сталь не застосовують при більш низьких температурах завдяки великому перетину захоплення.
Задовільна теплопровідність між паливом і оболонкою досягається при використанні зв”язуючих матеріалів, наприклад розплавленого натрію, порошкового графіту і ін. Власне матеріал оболонки повинен бути не тільки корозіонно-стійким під дією теплоносія при всіх температурах, але і не всту-пати в реакцію ні з паливним, ні із зв”язуючим матеріалами. Оболонка має бути тонкою при задові-льній механічній міцності та корозіонній стійкості.
Тепловидільні елементи, які застосовують в високотемпературних реакторах, з газовим теплоно-сієм, являють собою графітові стрижні або кулі, заповнені ядрами із оксидного або карбідного пали-ва, які отримують методом „золь – гель”. Ядра вкриті декількома шарами графіту і карбіду силіцію, які наносять шляхом піролізу метану або ацетилену в псевдозрідженому шарі ядер.
Паливо – важливий компонент економіки енергетичних ресурсів. Приблизно 20 % витрат на ви-робництво електроенергії в енергетичному реакторі можна віднести за рахунок ціни палива. Ці ви-трати приблизно нарівно розподіляються між ціною матеріалу, що ділиться, і витратами на вироб-ництво і переробку палива.
Дуже великого значення для експлуатації ядерних реакторів мають умови охолодження, які багато в чому залежать від типу реактору. Умови в реакторах з водяним охолодженням такі: температура менше 350 оС, тиск менше 16 Мпа і інтенсивне γ- і нейтронне випромінювання. Це потенціально створює жорсткі корозійні умови.
У реакторах з водяним теплоносієм і (або) уповільнювачем спостерігається значний розклад води під дією випромінення. Вода поглинає приблизно 2% загальної енергії γ- і нейтронного випроміню-вання. Це викликає утворення Н2, О2 і реактивних радикалів. В реакторі BWR теплової потужності 1 ГВт кисень утворюється із швидкістю 1 л/хв, в реакторі PWR – значно менше. Завдяки можливості утворення вибухонебезпечної суміші кисню і водню у всіх водяних реакторах є система каталітичної рекомбінації кисню і водню у воду.
Як утворювані радикали, так і О2 підвищують швидкість корозії реакторних матеріалів. В реакто-рі BWR швидкість корозії нержавіючої сталі (18 Cr 8 Ni) складає біля 10-4 мм/рік, що приводить до виділення невеликих кількостей Fe, Cr, Co i Ni в контурі теплоносія. Багато з цих елементів є високо-активними, наприклад 58Со і 60Со. Продукти корозії утворюють нерозчинені об”ємні колоїдо-подібні продукти. Окрім полімерних гідроксидів металів нерозчинені продукти містять і інші матеріали, які стикаються з теплоносієм: цирконій із матеріалу оболонок, мідь із системи конденсатору, силіцій і органічний матеріал з систем водоочищення, бор із системи регулювання реактору за допомогою борної кислоти і т.д., та матеріалів, які потрапили в контур теплоносія в результате витоку продуктів поділу. Відкладення забруднень цього типу на поверхнях збірок можуть утворювати пробки в охоло-джуючих каналах і завдяки низькій теплопровідності можуть також привести до прожигу оболонок твелів і до наступного попадання продуктів поділу в реакторну воду. Радіоактивні продукти поділу, що потрапили в контур охолодження, створюють серйозні проблеми опромінення обслуговуючого персоналу реактора. Тому значна увага приділяється розробці і відбору корозійностійких матеріалів. Важливий в цьому відношенні і вибір водного режиму, який зменшує до мінімуму корозію і відкла-дення таких продуктів в активній зоні реактору, і ефективних водоочищувальних систем.
Існує декілька способів зменшити корозію. Один складає підвищення рН води майже до 8 дода-ванням лугу, наприклад LiOH або NH3 (≤ 0,001 %). В реакторах американського типу для зменшення утворення тритію в результаті радіаційного захвату в 6Li застосовують 7LiOH, а в реакторах констру-кції СРСР – КОН. При використанні аміаку в результаті радіолізу виникають HNO2 і HNO3; в цьому випадку треба додавати газоподібний водень щоб змістити рівновагу в бік утворення молекули води. При концентрації Н2 біля 0,0002 % концентрація розчиненого кисню значно зменшується. Замість
NH3 у воду можна додавати гідразин або N2, щоб підвищити рН шляхом реакцій:
 ½ N2 + 3H NH3; NH3 + H2O NH4+ + OH-
½ N2 + 3H NH3; NH3 + H2O NH4+ + OH-
Вміст водню у воді слід підтримувати достатньо низьким, бо він підвищує крихкість оболонок твелів з циркалою. Чистоту реакторної води перевіряють, вимірюючи рН, провідність, мутність, концент-рацію кисню, радіоактивність і т.п. методом пробовідбору з наступним аналізом проб, або в поточно-му аналізі.
Переваги використання графіту в якості уповільнювача в порівнянні з водою полягає в основному в тому, що можливо досягти більш високої температури пари, але використання графіту має і інші переваги: як уповільнювач вік набагато краще звичайної води, дешевше важкої води і відрізняється механічною міцністю, що спрощує конструкцію активної зони.
ДІЯ ВИПРОМІНЮВАННЯ НА МЕТАЛИ
Метали представляють собою жорсткі кристалічні решітки атомів, чиї валентні електрони нале-жать не конкретному атому, а скоріше частково заповненій енергетичній зоні (зоні провідності). Взаємодія випромінення з металом може визвати збудження зв”язаних електронів в атомах і їх пере-хід в зону провідності. При знятті збудження електрони повертаються на первісні енергетичні рівні, що приводить лише до незначної зміни температури металу.
Якщо опромінення γ-квантами і електронами слабко впливає на властивості металу, то важкі частинки викликають серйозні ушкодження при взаємодії з атомами металу кристалічної решітки, що призводить до вибивання атомів з решітки.
Зміщення атомів викликає багаточисельні зміни властивостей металу. Звичайно, зростає електрич-ний опір, об”єм, твердість і границя міцності на розтягування або розрив і зменшуються щільність і пружність. Наприклад, опір міді зростає на 9 % після опромінення нейтронами з флюенсом 6 1020 нейтр./см2, а пружність вуглецевої сталі зменшується на 50 % при опроміненні нейтронами з енер-гією 1 МеВ і флюенсом 5 1019 нейтр./см2.
Мікрокристалічні властивості металів під дією опромінення частково змінюються. Якщо стальні сплави, які використовуються для корпусів сучасних реакторів, достатньо стійкі до опромінення (коли вони не містять домішок Cu, P i S), то нержаваіюча сталь (наприклад, яка містить 18 % Cr, 8 % Ni) при опромінення стає крихкою внаслідок утворення мікроскопічних гелієвих бульбашок в ре-зультаті реакцій (n, α) в 54Fe і в домішках легких елементів (N, B і ін.). Це явище ще більш підси-люється при опромінення металічного урану в реакторах внаслідок утворення газоподібних продук-тів розділу. В результаті такого радіаційного ефекту металічний уран неможливо використовувати в сучасних енергетичних реакторах, в яких досягаються високі дози випромінювання. Тому твели для енергетичних реакторів виготовляють із неметалічних сполук урану.
Деякі конструкційні матеріали в енергетиці
Мета цього розділу курсу – вивчити внутрішню будову конструкційних матеріалів і визначити зв”язки будови з механічними, хімічними, фізичними властивостями та хімічним складом, а також з технологічними і експлуатаційними впливами.

Конструкційні матеріали – матеріали для виготовлення деталей машин і механізмів, які забез-печують механічну міцність деталей під дією експлуатаційних навантажень. Найбільш розповсюд-жений матеріал для виготовлення деталей сучасних машин і механізмів – метал. Основні ознаки металів: * Наявність кристалічної решітки в твердому стані * Висока тепло- і електропроводність * Здатність до упругого і пластичного деформування * Зростання електричного опору при підвищенні температури * Характерний металічний блиск
Найбільше розповсюдження отримали чорні метали. На основі заліза виготовляється до 90 % всіх конструкційних і інструментальних матеріалів, що застосовуються в машинобудуванні. Конструкці-ні матеріали підрозділяють на металічні (сплави на основі заляза нікелю, міді, алюмінію, магнію, ти-тану, молібдену, вольфраму, ніобію...), неметалічні (пластики, термопластичні полімери, кераміка, вогнеупори, скло, резина, деревина, бетони, деякі гірські породи) і композиційні матеріали.
Після 2-ї Світової Війни почався швидкий розвиток виробництва рідкісних елементів (Р.е.), об-умовлений різноманітністю вимог до фізико-хімічних властивостей матеріалів для швидкісної авіації і ракетобудування, електроніки, атомної енергетики та ін. Потреба в легких жаростійких сплавах для авіації викликала освоєння у великих масштабах рідкісного на той час металу – титану. Атомна про-мисловість вимагала організації масштабного виробництва урану, торію, а також цирконію, берилію, літію і ін. рідкісних металів. Важливе значення мають рідкісні метали для виробництва спеціальних сталей, надтвердих, жароміцних і корозійностійких сплавів... На основі близькості фізико-хімічних властивостей, методів вилучення із сировини і технології виробництва, дається така класифікація рідкісних металів:
| Групи періо-дичної системи | Елементи | Група р.м. за технічною класифікацією |
| І ІІ | Літій, рубідій, цезій Берилій | Легкі |
| IV V VI VII | Титан, цирконій, гафній Ванадій, ніобій, тантал Молібден, вольфрам (Реній) | Тугоплавкі |
| III IV VI VII | Галій, індій. Талій Германій (гафній) Селен, теллур (Реній) | Розсіяні |
| III | Скандій, іттрій, лантан, лантаніди | Рідкісноземельні |
| I II III | Францій Радій Актиній і актиніди | Радіоактивні |
Тугоплавкі Р.м. відносяться до числа перехідних металів IV, V, VІ і VІІ груп періодичної систе-ми з недобудованими електронними d-рівнями. Ця особливість будови атомів перехідних металів обумовлює участь в міжатомних зв”язках не тільки зовнішніх s-електронів, але і d-електронів неза-повненого рівня, що призводить до значних сил міжатомного зчеплення в кристалах, а також обумо-влює їх перемінні валентності. Сильні міжатомні зв”язки проявляються в т.ч. в умовах високих тем-ператур плавління металів (від 1660 оС для Ті до 3410 оС для вольфраму). Завдяки вказаним особли-востям, перехідні елементи утворюють багаточисельні і різноманітні хімічні сполуки з іншими еле-ментами, а також різні інтерметаліди і тверді розчини з іншими металами, що дозволяє створювати різноманітні цінні сплави.
Розглянемо деякі конструкційні матеріали, що застосовуються в енергетиці. У зв”язку з тим,що головними серед них є метали, обговоримо їх деякі фізико-хімічні і кристалічні властивості. В твердому тілі атоми можуть розташовуватись у просторі двома способами:
- Неупорядковане розташування атомів, коли вони не займають певного місця один відносно другого. Такі тіла називаються аморфними. Аморфні речовини мають формальні ознаки твер-дих тіл, тобто вони здатні зберігати постійні об”єм і форму. Але вони не мають певної тем-ператури плавління або кристалізації
- Упорядковане розташування атомів, коли вони займають у просторі цілком визначені місця. Такі речовини – кристалічні.
Атоми здійснюють відносно свого середнього положення коливання з частотою біля 1013 Гц, амп-
літуда яких пропорційна температурі. Завдяки упорядкованому розташуванню атомів у просторі, їх центри можна з”єднати умовними прямими лініями. Сукупність таких ліній, які перетинаються, представляє просторову решітку, яку називають кристалічною решіткою. Зовнішні електронні орбіти атомів стикаються, тому щільність упаковки атомів в кристалічній решітці досить велика.
Кристалічні тверді тіла складаються із кристалічних зерен – кристалітів. В сусідніх зернах крис-талічні решітки розвернуті відносно одна одної на деякий кут.
В кристалітах дотримується близький і дальній порядки. Це означає наявність упорядкованого розташування і стабільності як оточуючих даний атом його найближчих сусідів (близький порядок), так і атомів, що знаходяться від нього на значних відстанях, майже до границь зерен (дальній порядок).

а) б)
Рис. 1.1. Розташування атомів в кристалічній (а)і аморфній (б) речовині
Внаслідок дифузії окремі атоми можуть покидати свої місця в узлах кристалічної решітки, але при цьому упорядкованість кристалічної будови в цілому не порушується.
Всі метали є кристалічними тілами, які мають певний тип кристалічної решітки, що складається з малорухомих позитивно заряджених іонів, між якими рухаються вільні електрони (електронний газ). Такий тип структури називається металічним зв”язком. Тип решітки визначається формою елемен-тарного гометричного тіла, багаторазове повторювання якого по трьох просторових осях утворює решітку даного кристалічного тіла.
а) Кубічна б) Об`ємно-центрована в) Гранецентрована г) Гексагональна
(1 атом на комірку) кубічна (ОЦК) (2 атоми на кубічна (ГЦК) щільноупакована (ГЩ)
|
|
|
|
1.2. Основні типи кристалічних решіток металів
Метали мають відносно складні типи кубічних решіток – об”ємно-центрована (ОЦК) і гранецент-рована (ГЦК) кубічна решітки. Основу ОЦК-решітки складає елементарна кубічна комірка (рис. 1.2, б), в якій позитивно заряджені іони металу знаходяться в вершинах кубу, і ще один атом в центрі його об”єму, тобто на перетині його діагоналей. Такий тип решітки в певних діапазонах температур мають залізо, хром, ванадій, вольфрам, молібден і інші метали. У ГЦК-решітки (рис. 1.2, в) елемен-тарною коміркою служить куб з центрованими гранями. Подібну решітку мають залізо, алюміній, мідь, нікель, свинець і ін. метали. Третім розповсюдженим різновидом щільноупакованих решіток є гексагональна щільноупакована (ГЩУ, рис. 1.2, г). ГЩУ-комірка складається з паралельних центри-рованих гексагональних основ, які відстоять одна від одної на параметр с. Три іона (атома) знаходя-ться на середній площині між основами. У гексагональних решіток відношення параметра с/а завжди більше одиниці. Таку решітку мають магній, цинк, кадмій, берилій, титан і ін.
Компактність кристалічної решітки або ступінь заповненості її об”єму атомами є важливою характеристикою. Вона визначається такими показниками, як параметр решітки, кількість атомів в кожній елементарній комірці, координаційне число і щільність упаковки.
Параметр решітки – це відстань між атомами по ребру елементарної комірки. Параметри кубічних решіток характеризуються довжиною ребра кубу (в нм) і позначаються літерою а. Для характеристи-ки гексагональної решітки приймають два параметри – сторону шостигранника а і висоту призми с.
Коли відношення с/а = 1,633, атоми упаковані найбільш щільно, - решітка називається гексагональ-
ною щільноупакованою (рис. 1.2, г). Метали з менш щільною упаковкою: с/а = 1,86 для цинку і 1,88
|
аналізу.
|
Під координаційним числом треба розуміти кількість найближчих сусідів даного атому.
Для ГПУ-решітки координаційне число дорівнює 12 (Г12).
Щільність упаковки представляє собою відношення сумарного об”єму, що займають атоми в кристалічній решітці, до її повного об”єму. Різні типи кристалічних решіток мають різну щільність упаковки атомів. В ГЦК-решітці атоми займають 74% всього об”єму решітки, а міжатомні проміжки (пори) 26%. В ОЦК-решітці атоми займають 68% всього об”єму, а пори – 32%. Компактність решітки залежить від особливостей електронної структури металів і характеру зв”язку між атомами. Від типу кристалічної решітки сильно залежать властивості металу.
Упорядкованість кристалічної будови в просторовій решітці дозволяє виділити окремі кристало-графічні напрями і площини. Кристалографічні напрями – це характерні прямі лінії, що визодять із точки відліку, вздовж яких в кристалічній решітці розташовуються атоми. Точками відліку можуть слугувати вершини кубу, а кристалографічними напрямами – його ребра і діагоналі, а також діа-гоналі граней.
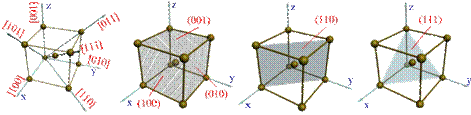
Рис. 1.4. Кристалографічні напрями і площини в кристалічній решітці: а) - основні напрями і
їх позначення; б), в), г) - основні площини і їх позначення
Під анізотропією треба розуміти неоднаковість механічних і інших властивостей в кристалічних тілах вздовж різних кристалографічних напрямах. Вона є природнім слідством кристалічної будови, бо на різних кристалографічних площинах і вздовж різних напрямів щільність атомів різна. Оскільки механічні, фізичні і хімічні властивості вздовж різних напрямів залежать від щільності розташованих на них атомів, то перераховані властивості вздовж різних напрямів в кристалічних тілах повинні бу-ти неоднаковими.
Анізотропія виявляється тільки в межах одного монокристалу або зерна-кристаліта. В полікриста-лічних тілах вона не спостерігається завдяки усередненню властивостей по кожному напряму для великої кількості зерен, що вільно орієнтовані одне відносно другого. Тому реальні метали є квазі-ізотропними, тобто псевдоізотропними.
Деякі метали, наприклад залізо, титан, олово і ін. здатні по досягненні певних температур змінювати кристалічну будову, тобто змінювати тип елементарної комірки своєї кристалічної ре-шітки. Це явище називається алотропією, або поліморфізмом, а самі переходи від одної кристаліч-ної будови до іншої – алотропні або поліморфні. Відоме на практиці немагнітне бета-залізо самостій-ною алотропічною формою не є, бо має таку ж як у альфа-заліза ОЦК-решітку і відрізняється від нього тільки відсутністю магнітних властивостей, які воно втрачає при 768°С (точка Кюрі).
В решітці реального металу можуть знаходитись різні дефекти. Вони бувають точкові, лінійні, по-верхневі і об”ємні. Точкові дефекти співрозмірні з розмірами атомів. До них відносяться вакансії, тобто незаповнені вузли решітки, міжвузлові атоми даного металу, домішкові атоми заміщення, тобто атоми, які за диаметром співрозмірні з атомами даного металу і т.д. Вплив цих дефектів на міцність металу може бути різним в залежності від їх кількості в одиниці об”єму і характеру.
Лінійні дефекти мають довжину, що значно перевищує їх поперечні розміри. До них відносяться дислокації, тобто дефекти, які утворюються в решітці в результаті зміщення кристалографічних площин. Дислокації бувають двох видів. Найбільш характерна крайова дислокація. Вона утворюється в результаті виникнення в решітці так званої напівплощини або екстраплощини (див. мал.).
|
|

|

Схема гвинтової
дислокації
Поверхневі дефекти включають в себе головним чином границі зерен (див. рис. нижче). На грани-
цях кристалічна решітка сильно деформована. В них накопичуються дислокації, які переміщуються зсередини зерен.
З практики відомо, що мілкозернистий метал міцніше крупнозернистого. Тому що у останнього менше сумарна довжина (міцність) границь, то можна зробити висновок, що поверхневі дефекти сприяють підвищенню міцності металу. Тому було створено декілька технологічних способів отримання мілкозернистих сплавів.
Об”ємні дефекти кристалічної решітки (тріщини, пори) зменшують
міцність металу.
Структура границі двох
сусідніх кристалічних
зерен
Контрольні питання
1. В чому суттєва різниця між будовою аморфних і кристалічних тіл? Що таке кристалічна решітка?
2. Перерахуйте основні типи комірок кристалічних решіток металів. Що таке параметри решітки?
3. Що розуміється під кристалографічними напрямами і площинами і як вони позначаються?
4. Що таке анізотропія властивостей в кристалах, чим вона обумовлена? Наведіть приклад.
5. Чому полікристалічні тіла є ізотропними? Що таке квазіізотропия (псевдоізотропія)?
6. Що таке алотропія (поліморфізм) металів і яке її практичне значення?
7. Що представляють собою крайові дислокації, яка їх роль в перебігу пластичної деформації металу і як вони впливають на його міцність?
8. Що таке щільність дислокацій і як вона впливає на характер змінення міцності металу?
Основні характеристики конструкційних металів
Алюміній - Хімічний елемент ІІІ групи періодичної системи (п.н. 13, ат. в. 26,98). Складається з одного стабільного ізотопу АІ27 (100 %). Зовнішня електронна оболонка атому АІ має будову 3s23p.
Вміст алюмінію в земній корі 8,80 ваг.%. По розповсюдженості у природі АІ займає третє місце, після O i Si. У вільному стані не зустрічається. Всі основні форми існування визначаються великою спорідненістю до кисню і здатністю заміщати атоми кремнію в силікатах. Відомо декілька сотень мінералів алюмінію. Промислове значення для виробництва АІ мають: боксит, який складається в основному із гідроксидів (АІООН, АІ(ОН)3 і ін. металів), нефелін – (Na, K)2SO4 * Al2(SO4)3 * 2SiO2.
У всіх своїх стійких сполуках АІ трьохвалентний, але при високих температурах він може бути одно- і навіть двох-валентним. АІ має дуже високу спорідненість до кисню, у повітрі вкривається суціль-ною тонкою плівкою оксиду, що захищає метал від подальшого окиснення. Особливо швидко окис-нюється АІ в розплавленому стані. Алюміній з окисною плівкою дуже стійкий у відношенні атмос-ферної корозії, морської води, концентрованої азотної кислоти і ін. реагентів. Згорянням АІ в тоці кисню досягається температура вище 3000 оС.
В промисловості АІ отримують електролізом розчину глинозему АІ2О3 в розплавленому криоліті Na3AlF6 (6-8 % Al2O3 i 94-92 % Na3AlF6). Звичайно в електроліт добавляють невелику кількість АІF3 і до 8-10 % суміші CaF2 i MgF2, що поліпшує показнаки процесу. Температура електролізу біля 950 оС, тобто значно вище т-ри плавління АІ, який отримується тому рідким.
За практичним застосуванням АІ займає одне з перших місць серед металів. Найважливіша галузь –виробництво легких сплавів на його основі. АІ – одна з самих розповсюджених легуючих домішок у сплавах на основі міді, магнію, титану, нікелю, цинку і заліза.
Сплави на основі АІ – з домішками Cu, Si, Mg, Zn, Mn, Ni, Fe, Ti та ін. (в сумі до 20%). Промислові А.с. звичайно вміщують не менше 2-3 легуючих елементів. Силіцій і залізо, якщо і не додаються спе-ціально, то присутні у всіх сплавах як неминучі домішки. Легуючі домішки вводяться в АІ головним чином для підвищення механічної міцності. При кристалізації А.с. утворюються підвищуючі механі-чну міцність АІ тверді розчини і інтерметалічні сполуки. Інтерметаліди в А.с. бувають подвійні (CuAl2, Mg2Si, MgZn2), потрійні (Al2CuMg) і більш складні, з неточно визначеною формулою (CuxMgySizAlu). Добавки і домішки зменшують пластичність, електро- і теплопровідність АІ. Розчини кислот, лугів і солей діють на А.с. як і на алюміній. В більшості середовищ А.с. менш стійкі проти корозії, ніж чистий АІ. В атмосфері сухого і вологого повітря, і повітря, забрудненого SO2, H2S, NH3, А.с. проявляють задовільну стійкість проти корозії.
Раніше виробництво А.с. стимулювалось гол. чином розвитком авіації. Тепер А.с. застосовують в ракетній техніці, в авиа-, авто-, судо- і приладобудуванні, в хімічному апаратобудівництві, і т.д. По широті застосування в народному господарстві А.с. займають 2-е місце після сталі і чавуну.
Cталі, що містять різні елементи, які помітно змінюють їх властивості, називаються легованими.
До легуючих елементів відносяться: Cr, Ni, Mn, Si, W, Mo, V, Co, Ti, Nb, Al, N, Zr, B, Ta i Cu. Лего-вані сталі відрізняються високими механічними та фізико-хімічними властивостями. Якщо кількість введених елементів перевищує їх границю розчинності, то утворюються інтерметалічні сполуки і, таким чином, в структурі, поряд з твердим розчином граничної концентрації, з”являються нові фази – сполуки легуючого елементу з залізом. Необмеженою розчинністю в γ-Fe при достатньо високій температурі володіє лише нікель, кобальт та метали групи платини, а в α-Fe – тільки хром і ванадій. При повільному охолодженні неперервні тверді розчини цих подвійних систем, в певному інтервалі концентрацій, утворюють сполуки: FeNi3, FeCo, FeCr i FeV. Марганець, вольфрам, молібден, титан, ніобій, алюміній і цирконій утворюють з залізом тверді розчини заміщення з обмеженою розчинніс-тю. Тверді розчини заглиблення утворюють карбон, бор і азот.
Леговані сталі розподіляються на три групи:
Конструкційні сталі, які використовують для виготовлення деталей машин. В залежності від умов, конструкційні сталі ділять на ті, що цементуються і ті, що поліпшуються.
Інструментальні сталі, які використовують для виготовлення різного інструменту (сред цих сталей: вуглецева інструментальна, легована інструментальна, штампова, швидкоріжуча).
Сталі з особливими властивостями: нержавіючі і кислотоупорні, жаропрочні і жаростійкі, стійкі до виснажування, з особливими магнітними властивостями і з високим електроопором).
Від конструкційних сталей вимагаються головним чином високі механічні властивості. Вони повинні мати достатню пластичність і в”язкість, щоб успішно протистояти динамічним і ударним навантаженням і, разом з тим, високою міцністю і витривалістю. Проста вуглецева сталь не завжди задовольняє ці вимоги і в таких випадках застосовуються леговані сталі. Позитивний вплив легую-чих елементів відбивається перш за все на вирівненні механічних властивостей деталей після зака-лювання і відпущення по всьому об”єму навіть при значних розмірах деталей. Разом з тим, легуючі елементи, розчинюючись у цементиті, протидіють його коагуляції при нагріванні і тим самим спри-яють підвищенню міцності, бо грудодисперсний цементит зменшує міцність. Крім цього, розташову-ючись по межах зерен твердого розчину, легуючі елементи утруднюють збірну рекристалізацію металу і таким чином перешкоджають зросту зерна, що також призводить до підвищення міцності.
Цирконій – Zr
Хімічний елемент IV групи періодичної системи (п.н. 40, ат. в. 91,22). До складу природного Ц. входять ізотопи: Zr90 (51,46%), Zr91 (11,23%), Zr92 (17,11%), Zr94 (17,40%), Zr96 (2,80%). Конфігу-рація зовнішніх електронів атому 4d25s2. Вміст Ц. у земній корі складає 2 10-2 ваг. %.
 Компактний Ц. – в хімічно чистому вигляді виключно ковкий та пластичний. Ц. утворює дві модифікації: низькотемпературну α- Zr з гексагональною решіткою і високотемпературну β- Zr з об”ємно-центрованою кубічною решіткою. Перехід α β відбувається при 862 ± 2о. Температура переходу підвищується при розчиненні в Ц. елементів O, N, C, Al, Hf i Sn; більшість інших елементів зменшує її. На твердість Ц. сильно впливає вміст кисню; так, при О2 > 0,2 % цирконій не піддається холодній обробці тиском. Одна з найбільш цінних властивостей Ц. – його значна стійкість проти корозії в хімічно агресивних середовищах. Металічний Ц. розчиняється в плавиковій і в гарячій концентрованій сірчаній кислотах, в „царській горілці” і в розплавлених фторидах лужних металів і не розчиняється в соляній і азотній кислотах та в розчинах луг. У водних розчинах сполуки Ц. ха-
Компактний Ц. – в хімічно чистому вигляді виключно ковкий та пластичний. Ц. утворює дві модифікації: низькотемпературну α- Zr з гексагональною решіткою і високотемпературну β- Zr з об”ємно-центрованою кубічною решіткою. Перехід α β відбувається при 862 ± 2о. Температура переходу підвищується при розчиненні в Ц. елементів O, N, C, Al, Hf i Sn; більшість інших елементів зменшує її. На твердість Ц. сильно впливає вміст кисню; так, при О2 > 0,2 % цирконій не піддається холодній обробці тиском. Одна з найбільш цінних властивостей Ц. – його значна стійкість проти корозії в хімічно агресивних середовищах. Металічний Ц. розчиняється в плавиковій і в гарячій концентрованій сірчаній кислотах, в „царській горілці” і в розплавлених фторидах лужних металів і не розчиняється в соляній і азотній кислотах та в розчинах луг. У водних розчинах сполуки Ц. ха-
рактеризуються високим ступенем гідролізу, утворенням полімерів і комплексних іонів.
 В сполуках Ц. чотирьохвалентний. В особливих умовах були отримані галогеніди і органічні спо-луки Ц., в яких він проявляє валентність 3, 2, 1 і 0. Величина стандартного потенціалу Ц. для реакції Zr0 + 2Н2О ZrО2 + 4Н+ + 4е- дорівнює -1,43 в.
В сполуках Ц. чотирьохвалентний. В особливих умовах були отримані галогеніди і органічні спо-луки Ц., в яких він проявляє валентність 3, 2, 1 і 0. Величина стандартного потенціалу Ц. для реакції Zr0 + 2Н2О ZrО2 + 4Н+ + 4е- дорівнює -1,43 в.
У повітрі металічний цирконій вкривається плівкою оксиду. Інтенсина взаємодія Ц. з киснем по-вітря починається при нагріві до 200 оС, але дрібно диспергований порошок металу є пірофорним і займається при звичайній темпратурі. Ц. може розчиняти до 60 ат.% кисню без зміни металічної структури. При подальшому поглинанні О2 утворюється діоксид ZrО2. При 300-800 оС порошковий Ц. швидко абсорбує водень з утворенням п”яти кристалічних фаз: (Zr2Н, ZrН, ZrН2 і др.) з металіч-ним зв”язком; гідриди легко розкладаються і водень можна видалити вакуумуванням з нагрівом. Азот починає реагувати з порошком Ц. з 400 оС, вище 800 оС реакція значно пришвидшується. При цьому метал поглинає до 20 ат.% азоту, утворюючи твердий розчин, який не розкладається в процесі термічної вакуумної обробки і при дії кальцію. Подальше поглинання азоту металом веде до утво-рення нітриду ZrN, який при 8,9 К характеризується надпровідністю.
Найбільш високоплавкою сполукою Ц. є карбід, який отримується при взаємодії оксиду металу з карбоном при 2000 оС. Карбід Ц. дуже стійкий, не реагує з водою при нагріванні; розчиняється у фтористоводневій кислоті, концентрованих сірчаній і азотній кислотах та в „царській горілці”. У по-вітрі при 700 оС згорає з утворенням ZrО2. З бором Ц. реагує лише при нагріванні вище 1500 оС; при цьому утворюється декілька боридів, виключно тугоплавких.
Основне застосування металічний цирконій, очищений від гафнію, знаходить як конструкційний матеріал в ядерній енергетиці; це обумовлено малим поперечним перетином захоплення теплових нейтронів і високою корозійною стійкістю сплавів Ц. з деякими легуючими домішками у воді. Крім цього, Ц. використовують в електровакуумній техніці, металургії (легуючий елемент), в хімічному машинобудуванні.
Сплави цирконію. Елементи, які утворюють з Zr тверді розчини, змінюють температуру α ↔ β пере-ходу гексагональної щільно упакованої структури в кубічну об”ємно центровану з відповідним роз-ширенням або звуженням області α- або β-твердих розчинів. Це дозволяє легуванням і термічною обробкою отримувати однофазні або двозфазні цирконієві сплави з різними фізико-хімічними влас-тивостями. Сплави цирконію поділяють на 5 типів:
- Ц.с. з переважанням α-твердого розчину (підвищення температури α ↔ β переходу), наприклад
Zr – Al, Zr – Sn, Zr – O, Zr – N
- Ц.с. з переважанням β-твердого розчину (зменшення температури α ↔ β переходу), наприклад
Zr – Nb, Zr – Ta, Zr – Th, Zr – U
- Ц.с. з евтектичним або евтектоїдним характером діаграм стану (типу Fe – Fe3C), напр., Zr – Ag,
Zr – Be, Zr – Co, Zr – Cr, Zr – Cu, Zr – Fe, Zr – Mn, Zr – Mo, Zr – Ni, Zr – V, Zr – W, Zr – H;
- Ц.с. з повною розчинністю в твердому стані, напр., Zr – Hf, Zr – Ti;
- Комбінації першого і третього, або другого і третього типів, напр., Zr – C, Zr – Ge, Zr – Si.
Найбільш широко використовуються Ц.с. в ядерній енергетиці у зв”язку з їх малим ефективним перетином захоплення теплових нейтронів, механічною міцністю при підвищених температурах (до 550-600 оС), високою корозійною стікістю при високих температурах у водних, лужних і в деяких кислих середовищах. До такого роду Ц.с. відносяться „циркалої” (1,3 – 1,6 % Sn, 0,07 - 0,2 % Fe, 0,05 – 0,16 % Cr, 0,03 – 0,08 % Ni, останнє Zr), які мають високу міцність (до 40 кг/мм2 при 500 оС), твер-дість по Брюнелю 180-210 кг/мм2, теплопровідність, що практично не змінюється до 400 оС, і харак-теризуються високою стійкістю у воді при підвищених температурах. Як конструкційний матеріал для атомних реакторів використовують також так звані „озгеніти” – Ц. с. із загальним вмістом Sn, Fe, Ni, Nb 0,5 – 1,5 %, корозійно стійкі у гарячій воді і парі до 400 оС, і інші сплави, які звичайно отри-мують легуванням цирконію молібденом, ніобієм, танталом, нікелем або гафнієм, що підвищує їх механічні властивості.
Ц.с. отримують звичайно дуговою або індукційною плавкою з наступним литтям у вакуумі або під тиском, чи методами порошкової металургії.
До Ц.с. можуть бути віднесені також різні тугоплавкі сполуки цирконію – карбід, борид, нітрид, силіцид, які використовують в різних галузях техніки в зв”язку з високими температурами плав-лення, низьким тиском пари, високою твердістю і стійкістю до агресивних речовин.
Титан – Ті – хімічний елемент IV групи періодичної системи (п. н. 22, ат. в.47,90); відноситься до переходних металів. Природний титан складається із суміші 5-ти стабільних ізотопів. Відомі радіо-активні ізотопи титану: Ті45 (Т1/2 = 3,09 год.), Ті51 (Т1/2 = 5,79 хв.). Перетин захоплення теплових нейт-ронів атомом Т. 5,6 барн. Конфігурація зовнішніх електронів атому: 3d24s2. Енергії іонізації (ев): Тіо → Ті+ → Ті2+ → Ті3+ → Ті4+ відповідно складають 6,82, 13,57, 27,47, 43,0.
Серед конструкційних металів Ті за розповісюдженістю займає четверте місце, поступаючись залізу, алюмінію і магнію. Його вміст в земній корі – 0,63 ваг.%. У вільному вигляді в природі Ті не зустрічається, а практично завжди – у сполуках з киснем. Природний діоксид ТіО2 кристалізується в трьох формах:
Рутил – мінерал темно-жовтого, бурого або червоного кольору, сінгонія тетрагональна, щільність 4,2-4.3, твердість за Моосом 6; вміщує 97 % ТіО2 з домішками Fe, Nb, Ta, Sn, Cr, V, Mo; в природі спостерігається як складова частина вивержених порід (аленіти, граніти), зустрічається в пегматитах і в деяких гідротермальних покладах.
Анатаз – мінерал буро-брунатного або чорного кольору, сінгонія тетрагональна. Вміщує 99 % ТіО2 з домішками Fe, зустрічається в пегматитах і кристалічних сланцях.
Брукіт – мінерал від червого-бурого до чорного кольору, сінгонія ромбічна. Вміщує 94-99 % ТіО2 з домішками Fe, Sn, Pb, S. Промислове значення мають і інші тітан-вміщуючі мінерали (ільменіт, перовскіт, лопарит...).
Титан, порівняно з іншими металами, має меншу щільність, високу корозійну стійкість, пластич-ність і міцність. Утворює дві алотропічні модифікації: α і β. В сполуках Ті 4-валентний, рідше – 3-х і 2-х валентний. При звичайній температурі і до 500-550 оС Ті корозійно стійкий і не змінюється у повітрі, що пояснюється наявністю на його поверхні тонкої, але дуже міцної і щільної оксидної плівки, яка добре захищає його від зовнішнього впливу.
При температурі червоного прожарювання Ті горить в тоці кисню з утворнням ТіО2. З підвищен-ням температури хімічна активність Т. підвищується, як і при видаленні оксидної плівки і активуван-ні поврхні Т. шляхом вакуумного відпалювання.
Кисень, азот, водень утворюють з Ті тверді розчини типу проникнення, що сильно зменшує плас-тичність титану, а при достатньо високому вмісті перетворює його в крихкий матеріал, непридатний для практичного використання. Тому всі високотемпературні процеси в технології Ті повинні відбу-ватись в атмосфері нейтрального газу або в вакуумі, щоб забезпечити достатньо низький вміст вказа-них домішок. Ті корозійностікий в багатьох агресивних середовищах, в т.ч. в морській воді і в морсь-кій атмосфері.
Ті взаємодіє з фтором при 150 оС, з хлором – при 300, з бромом – при 360, з йодом – при 550 оС, утворюючи відповідні галогеніди. При кімнатній температурі 2 грами порошкового Ті поглинають 407 см3 водню (адсорбція водню зворотня). Водень – шкідлива домішка, бо викликає крихке руйну-вання Ті. Шляхом вакуумного відпалювання при 800-1000 оС можна практично повністю видалити водень з титану. Стехіометричний гідрид ТіН2 отримано відновленням ТіО2 гідридом кальцію. З азотом Ті взаємодіє при нагріванні вище 700 оС з утворенням твердого поверхневого шару нітриду TiN. Він хімічно стійкий, нерозчинний у гарячих концентрованих соляній, азотній і сірчаній кисло-тах, розчиняється в кип”ячій царській горілці, в HF в присутності окиснювачей; розкладається під дією кип”ячого розчину КОН і в перегрітій парі, згідно з рівняннями реакцій:
 TiN + 2KOH + H2O K2TiO3 + NH3 + ½ H2
TiN + 2KOH + H2O K2TiO3 + NH3 + ½ H2
 TiN + 2 H2O TiO2 + NH3 + ½ H2
TiN + 2 H2O TiO2 + NH3 + ½ H2
TiN застосовують при виготовленні твердих інструментальних сплавів; він служить замість алмаз-ного пилу для шліфовки дорогоцінних каменів.
Існують різні технології виготовлення дуже цінних у різни х галузях нітридів, карбідів, силіци-дів, а також титанорганічних сполук титану.
Дуже значна роль титану як конструкційного матеріалу. Основна частина Т. витрачається на виго-товлення титанових сплавів підвищеної міцності для потреб авіаційної і ракетної техніки, та судобу-дівництва. Титанові сплави промислового значення утворюються шляхом легування металічного ти-тану алюмінієм, молібденом, ванадієм, марганцем, хромом, оловом, рідше цирконієм, ніобієм, залі-зом, силіцієм та міддю. При розробці титанових сплавів обов”язково враховується кількість кисню і азоту у вихідному титані, бо домішки цих газів дуже сильно підвищують міцність і твердість металу. В т. с. допускається не більше 0,15% кисню і не більше 0,05 % азоту. Комплекс властивостей т.с. виз-начається їх структурою, тому ці сплави розподіляють на три великі групи:
- сплави з альфа-структурою, що містять алюміній, олово і цирконій, а в деяких випадках невеликі кількості (0,5-1,5 %) інших металів, характеризуються відмінними якостіми зварювання і високим опором повзучості, погано піддаються холодній листовій штамповці, не холодоломкі.
- двохфазні сплави (змішана альфа-бета-структура) у більшості випадків також містять алюміній і, крім цього, до 10-12 % інших металів; мають підвищену технологічну пластичність, особливо при високих температурах, обмежену зварюваність, високу міцність при кімнатній і підвищених темпе-ратурах; здатні до зміцнюючої термічній обробці; при кріогенних температурах проявляють хладо-ломкість.
- сплави з бета-структурою – високолеговані т.с., які вміщують 15-20% важких металів (за виклю-ченням олова і цирконію) і до 3 % алюмінію. Ці сплави доволі хладоломкі і не відзначаються термічною стабільністю. Найбільш вигідний температурний інтервал їх застосування – від -70 до +300 оС.
Жароміцні т.с. застосовують переважно для кованих і штампованих деталей, які працюють при 300-500 оС (диски і лопатки компресорів газотурбінних двигунів). Зварювальні т.с. виготовляють головним чином у вигляді листів, застосовують для обшивки і внутрішнього силового набору літаль-них апаратів, для різного роду резервуарів, емностей, трубопроводів і арматури в хімічній промисло-вості. Термічно зміцнювані т.с. застосовують у вигляді листів, поковок і штамповок в тих випадках, коли потрібно поєднання високої міцності і малої щільності. Технічний титан і деякі сплави застосо-вують в криогенній техніці, бо вони не схильні до холодоломкості.
РЕКОМЕНДОВАНА ЛІТЕРАТУРА
1. Громов Б.В. Введение в химическую технологию урана. М.: Атомиздат. – 1978, 336 с.
2. Чоппин Г., Ридберг Я. Ядерная химия. Основы теории и применения. – М.: Энергоатомиздат, 1984, 304 с.
| 3. Громов Б. В., Савельева В. И., Шевченко В. Б. Химическая технология облученного ядерного топлива. – М.: Энергоатомиздат, 1983. 4. Землянухин В.И., Ильенко Е.И., Кондратьев А.Н. и др. Радиохимическая переработка ядерного топлива АЭС. – М.: Энергоатомиздат, 1989. 5. Никифоров Ф.С., Кулиниченко В.В., Жихарев М. И. Обезвреживание жидких радиоактивных отходов. – М.: Энергоатомиздат, 1985. 6. Кесслер Г. Ядерная энергетика. Пер. с англ. М.: Энергоатомиздат, 1986. |
| 7. І. Вишневський, В. Давидовський, А. Трофименко. Екологічно чиста атомна енергетика: технічні, економічні, соціальні, політичні аспекти. Вісник НАН України. №9, 2001. 8. Energy, Electricity and Nuclear Power Estimates for the Period up to 2020. IAEA. ‑ Vienna, 2000. 9. Z. Mian, A.H. Nayyar, Science and Global Security. Vol. 10, 2002, pp. 151 – 179. |
10. Блюменталь У.Б. Химия циркония. Пер. с англ. М., 1963.
11. Филянд М.А., Семенова Е.И. Свойства редких елементов, 2 изд., М.:1964.
12. Еременко В.Н. Титан и его сплавы. 2-е изд., Киев, 1960.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 2098; Нарушение авторских прав?; Мы поможем в написании вашей работы!




