
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 12. Електрохімічні процеси. Корозія та захист металів
|
|
|
|
Електрохімія – розділ фізичної хімії, який розглядає системи, що містять іони (розчини або розплави електролітів) а також процеси, що проходять на границі двох фаз за участю заряджених частинок – іонів і електронів. В двохфазній системі однією із фаз частіше за все є метал або напівпровідник, другою – розчин або розплав електроліту. В ряді випадків (але не завжди) така взаємодія супроводжується появою електричного струму в ланцюгу.
Перші уявлення про взаємозв”язок електричних і хімічних явищ відносяться до середини 18 ст. Але лише на межі 18 і 19 ст.ст. Вольта створив перше хімічне джерело струму („вольтовий стовп”), яке представляло собою батарею послідовно з”єднаних 15-20 гальванічних елементів. Електродами в них були диски із міді і цинку (або із срібла і олова), а електролітом – губчатий матеріал (сукно або бумага), насичений солоною водою або кислотою. З”єднання за допомогою металічного провідника двох крайніх дисків вольтова стовпа вперше дозволило отримати електричний струм. Після винаходу динамо-машини гальванічні елементи тимчасово відійшли на другий план, а в наші часи їх роль знову зросла у зв”язку з розвитком електроніки, ракетної техніки і др., для чого потрібні автономні хімічні джерела струму.
Згідно уявленням Вольта, електрична енергія в гальваничному елементі виникає в результаті контакту двох різних металів (контактна теорія). Основою для цієї теорії служить таке явище. Якщо два різних метали привести у стикання, а потім розсунути, то за допомогою електроскопу можна виявити, що один метал придбав позитивний заряд, а другий – негативний. Ряд металів, в якому кожний попередній метал заряджається позитивно після контакту з любим наступним, тобто ряд Вольта, виявився у деякій мірі аналогічним ряду напруження. Звідси Вольта зробив висновок, що е.р.с. гальва-нічного елемента обумовлена виключно контактною різницею потенціалів. Але теорія Вольта не пояснювала виникнення електричної енергії при роботі гальванічного елементу, тому що навіть при довготривалому протіканні струму границя стикання двох металів не змінюється. Після встановлення в науці закону збереження енергії для пояснення е.р.с. гальв. елементу була висунута хімічна теорія (праці В.Нернста), згідно якої джерелом електричної енергії в гальв. елементі є енергія хімічної реакції
Zn + H2SO4 = ZnSO4 + H2
у випадку мідно-цинкового елементу з розчином H2SO4 в якості електроліту.
Правильне вирішення питання про механізм виникнення е.р.с. гальв. елементу стало можливим лише в 30-40-ві роки 20 ст. Завдяки розвиткові фізики металів (А.Фрумкін, М.Темкін і ін.). Згідно Фрумкіну, величина е.р.с. елементу виражається через контакту різницю потенціалів на межі двох металів і суму стрибків потенціалу у подвійних електричних шарах на границі між електродом і розчином електроліту. В той же час, енергія гальв. елементу цілком визначається енергією процесів на границях між електродами і розчином електроліту.
Інше питання, що виникло вже при створенні першого гальв. елементу: як буде діяти проходження електричного струму через розчини кислот і солей. Вже в перших дослідах з вольтовим стовпом на початку 19 ст. було показано, що при пропусканні струму через провідники 2-го роду відбуваються хімічні перетворення з виділенням продуктів реакції на електродах, що отримало назву електролізу. Так була розщеплена вода на водень і кисень, а шляхом електролізу трохи змочених водою твердих гідроксидів NaOH і KOH вперше отримані металічні Na і К. Завдяки працям російського вченого Якобі (1836 р) по електрохімічному відновленню металу із його солі на катоді, виник прикладний напрям електрохімії – гальванотехніка. Після створення динамомашини і отримання дешевої електроенергії виникла можливість промислового використання електрохімічних методів. Сучасне електрохімічне виробництво включає електроліз водних розчинів без виділення металу, електрометалургію і електросинтез різних органічних сполук. Потужність сучасних електрохімічних підприємств можна охарактеризувати силою струму, що протікає через електролітичні ванни і суточними витратами електроенергії. В ряді випадків ел. струм у ваннах досягає 180-200 тис. А, а добові витрати енергії складають сотні млн квт-год. Шляхом електролізу без виділення металів отримують водень, кисень, важку воду, хлор і фтор. Цей метод використовують також для отримання H2O2, KMnO4, MnO2, K3Fe(CN)6, персульфатів, хлоратів, перхлоратів і деяких інших сполук.
Електрометалургія в свою чергу підрозділяється на електроекстракцію, електролітичне рафіну-вання і електроліз розплавів. Електроекстракція, тобто електроліз водного розчину солі даного металу з метою його виділення, служить для отримання чистих металів (99,5 - 99,9 %): Cu, Zn, Cd, Co, Fe, Mn i Cr. Електролітичне рафінування використовують для очистки металів, отриманих при хімічному відновленні руд або концентратів в різних печах. Воно полягає в анодному розчиненні забрудненого металу і одночасному відкладенні на катоді чистого, рафінованого металу. Нерозчинені у воді домішки осідають на дно електролітичної ванни у вигляді шламу. У великих промислових масштабах цей метод використовують для очистки Cu, Ag, Au, Pb, Sn, Bi i Ni. Для рафінування Al використовують розплав солі із складом NaF. 2 Al(C4H9)3. Кількість домішок в отриманому таким чином алюмінії не перевищує 0,01 %. Третя група електрометалургійних процесів зв”язана з електролізом розплавів солей. Цим методом отримують Al, Mg, Li, Na, K, Rb, Cs, Ca, Sr, Ba, порошки тугоплавких металів W, Mo, V, Ti, Zr, Ta, Nb, а також чисті метали Be, Tl i U.
Прикладом електросинтезу органічних сполук служить електрохімічний синтез Кольбе, в резу-льтаті якого відбувається димерізація реагуючих молекул (синтез діефірів адипінової і себацинової кислот, а також діаміду себацинової кислоти, що є цінними продуктами в виробництві пластичних мас). Важливе місце займає процес електрогалогенування, зокрема електрофторування. Деякі з цих процесів доведені до промислових масштабів. Крім того, метод електрохімічного синтезу є найбільш доцільним і перспективним для отримання проміжних продуктів при синтезі лікарських препаратів і вітамінів.
Поглиблене вивчення роботи гальванічних елементів, а також процесів електролізу поставило питання про те, чим визначається швидкість електрохімічних реакцій і чи можна регулювати цю швидкість, змінюючи параметри електрохімічної системи. Було знайдено (середина 19 ст), що для проведення електролізу з достатньою швидкістю необхідно значно змістити потенціал електроду відносно його рівноважного значення. Це зміщення потенціалу – поляризація, або перенапруження – було пояснено наявністю на границі між електродом і розчином особливого перехідного опору. При такій інтерпретації цього явища між перенапруженням і щільністю струму повинна була б існувати лінійна залежність, тобто у випадку електролізу мав би виконуватись закон Ома. Але було виявлено, що ця залежність значно складніше. В 1932 р. Фрумкін об”єднав основні положення теорії уповільне-ного розряду з теорією подвійного електричного шару. Створена таким чином теорія в подальшому послужила основою сучасного вчення про кінетику електродних процесів. Остання тісно зв”язана з явищем корозії металів, оскільки більша частина корозійних процесів має електрохімічну природу. Дійсно, при корозійному процесі на поверхні металу одночасно і з рівною швидкістю йдуть дві електро-хімічні реакції: анодний розчин металу і катодне виділенні водню. Швидкість цих реакцій і визначає швидкість корозії. Тому знання закономірностей, яким підпорядкована швидкість електродних процесів, дозволяє розробляти найбільш ефективні методи боротьби з корозією.
Завдяки використанню електрохімічних методів, електрохімія тісно зв”язана з іншими розділами фізичної хімії, а також з аналітичною хімією. Так, наприклад, електрохімічні методи широко вико-ристовують при визначенні коефіціентів активності, теплових ефектів реакцій, а також для установ-лення констант рівноваги в різних системах. На електрохімічних явищах засновані такі види титру-вання: кондуктометричне (по залежності електропровідності від концентрації), потенціометричне (по залежності потенціалу електрода від концентрації потенціал-визначаючих іонів) і амперометричне (по залежності струму від концентрації речовини, що розряджується). Особливе місце серед різних аналітичних методів займає полярографічний метод, за допомогою якого по залежності струму від потенціалу ртутного крапельного електроду можна швидко виконувати якісний і кількісний аналізи багатокомпонентних систем. Про чутливість полярографічних методів говорить, наприклад, можливість визначення 10-10 г речовини в 1 мм3 розчину, що аналізується.
Електрохімія тісно також зв”язана з колоїдною хімією, оскільки проблеми будови подвійних електри-чних шарів, електрокінетичні явища, а також явища адсорбції на заряджених поверхнях представляють собою граничну область між електрохімією і колоїдною хімією.
Розчини – гомогенні системи, що містять не менше двох речовин. В залежності від того, електронейт-ральними або зарядженими частинками є компоненти розчину, їх підрозділяють на молекулярні (роз-чини неелектролітів) і іонні (розчини електролітів). Одна із характерних особливостей розчинів елект-ролітів полягає в тому, що вони проводять електричний струм. Розчинення речовин супроводжується тепловим ефектом: виділенням або поглинанням теплоти – в залежності від природи речовини. При розчиненні у воді, наприклад, гідроксиду калію, сірчаної кислоти відбувається сильний розігрів розчину, тобто виділення теплоти, а при розчиненні нітрату амонію - сильне охолодження розчину, тобто погли-нання теплоти. В першому випадку іде екзотермічний процес (∆H < 0), а в другому – ендотермічний (∆H > 0). Теплота розчинення ∆H – це кількість теплоти, що виділяється або поглинається при розчиненні 1 моль речовини. Так, для гідроксиду калія ∆H ° = -55,65 кДж/моль, а для нітрату амонія ∆H ° = +26,48 кДж/моль.
В результаті хімічної взаємодії розчиненої речовини з розчинником утворюються сполуки, які нази-вають сольватами (або гідратами, якщо розчинником є вода). Утворення таких сполук ріднить розчини з хімічними сполуками. За хімічною теорією розчинів Д.І.Менделеєва: сольвати (гідрати) утворюються за рахунок донорно-акцепторної, іон-дипольної взаємодій, завдяки водневим зв”язкам, а також диспер-сійній взаємодії (у випадку розчинів споріднених речовин, наприклад бензолу і толуолу). Особливо схильні до гідратації іони. Вони приєднують полярні молекули води, в результаті утворюються гідра-товані іони; тому, наприклад, в розчині іон міді (ІІ) блакитний, в безводному сульфаті міді він безбарв-ний. Багато з таких сполук неміцні і легко розщеплюються при виділенні їх у вільному стані, але в ряді випадків утворюються міцні сполуки, які можна легко виділити із розчину кристалізацією. При цьому випадають кристали, що містять молекули води – кристалогідрати. Вода, що входить до складу криста-логідратів – кристалізаційна. Багато природних мінералів є кристалогідратами.
Отже, розчинення - не тільки фізичний, але і хімічний процес. Розчини утворюються шляхом взає-модії частинок розчиненої речовини з частинками розчинника. Рідкі розчини займають проміжний стан між хімічними сполуками постійного складу і механічними сумішами. Але, на відміну від хімічних сполук розчини не підпорядковані закону постійності складу. Вони, як і суміші, можуть бути легко розділені на складові частини. Процес розчинення – це фізико-хімічний процес, а розчини – фізико-хімічні системи. Кількісний склад розчину частіше за все виражають через поняття „концентрації”, під яким розуміють вміст розчиненої речовини „Х” (в певних одиницях) в одиниці маси або об”єму розчинника „S”. Для вираження складу розчина використовують масову долю, молярну концентрацію (молярність) і мольну долю. Масова доля - це відношення маси розчиненої речовини до загальної маси розчину. Для бінар-ного розчину:
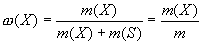 (1)
(1)
де ω(Х) - масова доля розчиненої речовини X; m(Х) маса розчиненої речовини X, г; m(S) - маса розчинника S, г; m= [m(Х) + m(S)] - маса розчину, г.
Масову долю виражають в долях одиниці або у відсотках (напр. ω = 0,01 или ω = 1%). Молярна концентрація (молярність) показує число молей розчиненої речовини, що міститься в 1 л розчину:
С(Х) = v(Х) / V, (2)
де С(Х) – молярна концентрація розчиненої речовини Х, моль/л; v(Х) – кількість розчиненої речовини Х, моль; V – об”єм розчину, л. Із (2) видно, що молярна концентрація виражається через моль/л. Ця розмірність іноді позначується - М, наприклад 2М NаОН.
Мольна доля розчиненої речовини – безрозмірна величина, рівна відношенню кількості розчиненої речовини до загальної кількості речовини в розчині:
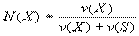 (3)
(3)
де N(X) – мольна доля розчиненої речовини Х; v(Х) – кількість розчиненої речовини Х, моль; v(S) – кількість речовини розчинника S, моль. Сума мольних долей розчиненої речовини і розчинника дорівнює 1:
N(X) + N(S) = 1. (4)
При вирішенні багатьох задач доцільно переходити від молярної концентрації до масової долі, мольній долі і т.д. Наприклад, молярна і відсоткова концентрації взаємозв”язані так:
C(X) = 10 ∙ ω(X) ∙ ρ / M(X), (5)
ω(X) = C(X) ∙ M(X) / (10 ∙ ρ) (6)
де ω(Х) - масова доля розчиненої речовини, виражена в %; М(Х) - молярна маса розчиненої речовини, г/моль; ρ = m/(1000 V) – щільність розчину, г/мл.
Дуже часто концентарцію насиченого розчину, разом з вищепереліченими характеристиками, вира-жають через так званий коефіціент розчиненості, або просто розчиненість речовини. Відношення маси речовини, що створює насичений розчин при даній температурі, до маси розчинника називають коефі-ціентом розчиненості:
ks = m р-ни / mр-ка. (7)
Розчинність розчинника показує максимальну масу речовини, яка може розчинитися в 100 г розчин-ника:
s = (mр-ни / mр-ка) ∙ 100. (8)
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 781; Нарушение авторских прав?; Мы поможем в написании вашей работы!