
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Електроліти і неелектроліти. Добре відомо, що одні речовини в розчиненому або в розплавленому стані проводять електричний струм, а другі в тих же умовах – не проводять
|
|
|
|
Добре відомо, що одні речовини в розчиненому або в розплавленому стані проводять електричний струм, а другі в тих же умовах – не проводять. На цій схемі: якщо опустити вугільні електроди в розчин цукру, лампочка не загориться, а в розчин хлориду натрію – загориться.

Електроліти – кислоти, основи, практично всі солі; неелектроліти – більшість органічних сполук, а також речовини, в молекулах яких є тільки ковалентні неполярні або малополярні зв”язки. Електроліти – провідники другого роду. В розчині або розплаві вони розщеплюються на іони, завдяки чому і проті-кає струм. Очевидно, що чим більше іонів в розчині, тим краще він проводить електричний струм. Чис-та вода струм проводить дуже погано. Розпад електролітів на іони при розчиненні їх в воді – електро-літична дисоціація. Так, хлорид натрію NaСl при розчиненні в воді практично повністю розкладається на іони натрію Na+ і хлорид-іони Cl-. Вода утворює іони водню Н+ і гідроксид-іони ОН- лише в дуже незначних кількостях.
Сильні електроліти при розчиненні у воді дисоціюють на іони. До них відносяться: практично всі солі, велика кількість мінеральних кислот (Н2SO4, HNO3, НСl, HBr, HI, НМnО4, НСlО3, НСlО4), основи лужних і лужно-земельних металів. Слабкі електроліти при розчинення у воді лише частково дисоцію-ють на іони; до них відносяться практично всі органічні кислоти, деякі мінеральні кислоти (H2СО3, Н2S, НNO2, HClO, H2SiO3), багато основ металів (крім основ лужних і лужно-земельних металів), а також NH4OH, який можна зобразити як гідрат аміаку NH3∙H2O. Вода – слабкий електроліт.
Теорія електролітичної дисоціації
Для пояснення особливостей водних розчинів електролітів шведським вченим С.Арреніусом в 1887 р. була запропонована теорія електролітичної дисоціації. Сучасний зміст цієї теорії можна звести до
3-х положень:
1. Електроліти при розчиненні у воді розпадаються (дисоціюють) на іони – позитивні і негативні. Іони знаходяться в більш стійких електронних станах, ніж атоми. Вони можуть складатися із одного атома – це прості іони (Na+, Mg2+, Аl3+ і т.д.), або з декількох атомів - це складні іони (NО3-, SO2-4, РОЗ-4 і т.д.).
2. Під дією електричного струму іони рухаються спрямовано: позитивно заряджені іони рухаються до катоду, негативно заряджені – до аноду. Тому перші – катіони, другі – аніони. Спрямований рух іонів відбувається в результаті притяжіння їх протилежно зарядженими електродами.
3. Дисоціація – зворотній процес: паралельно з розпадом молекул на іони (дисоціація) відбувається процес з”єднання іонів (асоціація). Тому в рівняннях електролітичної дисоціації замість знаку рівності стоїть знак зворотності. Рівняння дисоціації молекули електроліту КА на катіон К+ і аніон А- в загаль-ному вигляді:
КА  K+ + A-
K+ + A-
Теорія електролітичної дисоціації є однією з основних теорій в неорганічний хімії і повністю узгоджу-ється з атомно-молекулярним вченням і теорією будови атому.
Суттєвим є питання про механізм електролітичної дисоціації.
Легше за все дисоціюють речовини з іонним зв”язком. При їх розчиненні диполі води орієнтуються навкруги позитивного і негативного іонів. Між іонами і диполями води виникають сили взаємного при-тяжіння. В результаті зв”язок між іонами слабне, іони переходять із кристалу у розчин. При цьому утворюються гідратовані іони, тобто іони, хімічно зв”язані з молекулами води.
Аналогічо дисоціюють і електроліти, молекули яких утворені по типу полярного ковалентного зв”язку (полярні молекули). Навкруги кожної полярної молекули речовини також орієнтуються диполі води, які своїми негативними полюсами притягуються до позитивного полюсу молекули, а позитивними полюса-ми – до негативного полюсу. В результаті цієї взаємодії зв”язуюча електронна хмара (електронна пара) повністю зміщується до атому з більшою електронегативністю. Полярна молекула перетворюється в іонну і потім легко утворюються гідратовані іони. Дисоціація полярних молекул може бути повною або частковою.
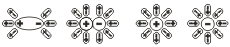
Таким чином, електролітами є сполуки з іонним або полярним зв”язком - солі, кислоти і основи. Дисоціювати на іони вони можуть в полярних розчинниках.
Дисоціація кислот, основ і солей у водних розчинах. За допомогою теорії електролітичної дисоціації дають визначення і описують властивості кислот, основ і солей. Кислоти – електроліти, при дисоціації яких в якості катіонів утворюються тільки катіони водню
Н3РО4  Н+ + Н2РО-4 (перший ступінь)
Н+ + Н2РО-4 (перший ступінь)
Н2РО-4  Н+ + НРO2-4 (другий ступінь)
Н+ + НРO2-4 (другий ступінь)
НРО2-4  Н + PОЗ-4 (третій ступінь)
Н + PОЗ-4 (третій ступінь)
Дисоціація багатоосновної кислоти протікає головним чином по першому ступіню, в меншій мірі - по другому і лише в незначній мірі – по третьому. Тому у водному розчині, наприклад, фосфорної кислоти одочасно з молекулами Н3РО4 існують іони (в кількостях, що послідовно зменшуються) Н2РО2-4, НРО2-4 і РО3-4. Основами називають електроліти, при дисоціації яких в якості аніонів утворюються лише гідрок-сид-іони. Наприклад:
KOH  K+ + OH-; NH4OH
K+ + OH-; NH4OH  NH+4 + OH-
NH+4 + OH-
Основи, розчинені у воді, називаються лугами. Їх небагато. Це основи лужних і лужно-земельних металів: LiOH, NaОН, КОН, RbОН, СsОН, FrОН і Са(ОН)2, Sr(ОН)2, Ва(ОН)2, Rа(ОН)2, а также NН4ОН. Більшість основ у воді малорозчинені. Кислотність основи визначається числом її гідроксильних груп (гідроксогруп). Наприклад, NН4ОН – однокислотна основа, Са(ОН)2 – двокислотна, Fе(ОН)3 - трьох-кислотна і т.д. Двох- і багатокислотні основи дисоціюють ступіньчасто
Ca(ОН)2 Са(ОН)+ + OH- (перший ступінь)
Са(ОН)+ + OH- (перший ступінь)
Ca(OH)+ Ca2++OH- (другий ступінь)
Ca2++OH- (другий ступінь)
Але існують електроліти, які при дисоціації одночасно утворюють катіони водню і гідроксид-іони. Ці електроліти називають амфотерними або амфолітами. До них відносяться Н2О, гідроксиди цинку, алю-мінію, хрому і ряду інших речовин. Вода, наприклад, дисоціює на іони Н+ і ОН- (в незначній кількості):
Н2O  Н+ + ОН-
Н+ + ОН-
Отже, у неї в рівній мірі виражені і кислотні властивості, обумовлені наявністю катіонів водню Н+, і основні властивості за рахунок іонів ОН-. Дисоціацію амфотерного гідроксиду цинку Zn(ОН)2 можна виразити рівнянням
2ОН- + Zn2+ + 2Н2О  Zn(ОН)2 + 2Н2О
Zn(ОН)2 + 2Н2О  [Zn(ОН)4]2-+ 2Н+
[Zn(ОН)4]2-+ 2Н+
Солями називають електроліти, при дисоціації яких утворюються катіони металів, а також катіон амонію (NH+4) і аніони кислотних залишків, наприклад
(NH4)2SO4  2NH+4 + SO2-4; Na3PO4
2NH+4 + SO2-4; Na3PO4  3Na+ + PO3-4
3Na+ + PO3-4
Так дисоціюють середні солі. А кислі і основні солі дисоціюють ступіньчасто. У кислих солей спочатку
відщеплюються іони металів, а потім – катіони водню. Наприклад:
KHSO4  K+ + HSO-4 і далі HSO-4
K+ + HSO-4 і далі HSO-4  H++SO2-4
H++SO2-4
У основних солей спочатку відщеплюються кислотні залишки, а потім гідроксид-іони:
Mg(OH)Cl  Mg(OH)++Cl- і далі: Mg(OH)+
Mg(OH)++Cl- і далі: Mg(OH)+  Mg2+ + OH-
Mg2+ + OH-
Основність кислоти визначається числом катіонів водню, які утворюються при дисоціації. Так, НCl, HNO3 – одноосновні кислоти – утворюється один катіон водню; Н2S, Н2СО3, Н2SO4 - двохосновні, а Н3РО4, Н3АsО4 – трьохосновні. Із чотирьох атомів водню в молекулі оцтової кислоти СН3СООН лише один, що входить в карбоксильну групу – СООН, здатний відщеплюватись у вигляді катіону Н+, - оцтова кислота одноосновна.
Двох- і багатоосновні кислоти дисоціюють ступінчасто (поступово).
Ступінь дисоціації
Оскільки електролітична дисоціація – процес зворотній, то в розчинах електролітів поряд з їх іонами присутні і молекули. Тому розчини електролітів характеризуються ступенем дисоціації (позначається літерою α). Ступінь дисоціації – це відношення числа молекул N', що розпались на іони, до загаль-ного числа розчинених молекул N. Ступінь дисоціації електроліту визначається дослідним шляхом і виражається в долях одиниці або у відсотках. Якщо α = 0, дисоціація відсутня, а якщо α = 1, або 100%, електроліт повністю розпадається на іони. Якщо ж α = 20%, то це значить, що із 100 молекул даного електроліту 20 розпалось на іони. Різні електроліти мають різний ступінь дисоціації. Він залежить від концентрації електроліту і від температури. Із зменшенням концентрації електроліту, тобто при розбав-ленні його водою, ступінь дисоціації завжди збільшується. Збільшує ступінь дисоціації і підвищення температури. За ступенем дисоціації електроліти ділять на сильні і слабкі.
Розглянемо зміщення рівноваги, яке відбувається між недисоційваними молекулами і іонами при електролітичній дисоціації слабкого електроліту – оцтової кислоти:
СН3СООН СНзСОO-+ Н+
СНзСОO-+ Н+
При розбавленні розчину оцтової кислоти водою рівновага зміщується в бік утворення іонів, - ступінь дисоціації кислоти підвищується. Навпаки, при випаровуванні розчину рівновага зміщується в бік утво-рення молекул кислоти – ступінь дисоціації зменшується.
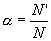
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1573; Нарушение авторских прав?; Мы поможем в написании вашей работы!