
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реакції іонного обміну
|
|
|
|
Згідно теорії електролітичної дисоціації, всі реакції в водних розчинах електролітів є реакціями між іонами. Вони називаються іонними реакціями, а рівняння цих реакцій – іонні рівняння. Вони простіше рівнянь реакцій, записаних в молекулярній формі, і мають більшь загальний характер. При складанні іонних рівнянь реакцій слід керуватись тим, що речовини малодисоційовані, малорозчинювані (що випадають в осад) і газоподібні записуються в молекулярній формі. Знак ↓, який стоїть при формулі речовини, означає, що ця речовина уходить із сфери реакції у вигляді осаду; знак ↑ означає, що речовина видаляється із сфери реакції у вигляді газу. Сильні електроліти, які повністю дисоційовані, записують у вигляді іонів. Сума електричних зарядів лівої частини рівняння повинна дорівнювати сумі електричних зарядів правой частини. Розглянемо два приклади.
Приклад 1. Напишіть рівняння реакцій між розчинами хлориду заліза (ІІІ) і гідроксиду натрію в молекулярній і іонній формах.
Розіб”ємо рішення задачі на чотири етапи.
1. Запишемо рівняння реакції в молекулярній формі:
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl
2. Перепишемо це рівняння, зображуючи добре дисоціюючі речовини у вигляді молекул:
FeЗ+ + 3Cl- + 3Nа+ + 3ОН- = Fе(ОН)3↓ + 3Nа+ + 3Cl-
Це – іонне рівняння реакції.
3. Виключимо з обох частин іонного рівняння однакові іони, тобто іони, які не приймають участі у реакції (вони підкреслені):
Fe3+ + 3Cl - + 3Na - + 3ОН- = Fе(ОН)3↓ + 3Na ++ 3Cl -.
4. Запишемо рівняння реакції в кінцевому вигляді:
Fe3+ + 3ОН- = Fe(OH)3↓ Це скорочене іонне рівняння реакції. Як видно, сутність реакції зводиться до взаємодії іонів Fe3+ і ОН-, в результаті чого утворюється осад Fе(ОН)3. При цьому зовсім не має значення, до складу яких електро-літів входили ці іони до їх взаємодії.
Приклад 2. Напишіть рівняння реакцій між розчинами хлориду калія і нітрату натрія.
Оскільки продукти взаємодії добре розчинені у воді і не уходять із сфери реакції, то дана реакція зворотня. Як і в Прикладі 1, записуємо по етапах:
KCl + NaNO3  KNO3 + NaCl
KNO3 + NaCl
K++Cl-+Na++NO-3  K++NO-3+Na++Cl-
K++NO-3+Na++Cl-
Рівняння для наступних етапів написати не можна, бо з точки зору теорії електролітичної дисоціації реакція не відбувається. Але, якщо випаровувати цей розчин, будуть виникати нові хімічні зв”язки між іонами і отримається суміш чотирьох солей: КСl, NаNО3, NaСl, КNO3. Іонними рівняннями можуть бути зображені будь-які реакції, що протікають в розчинах між електролітами. Якщо при таких реакціях не відбувається зміни зарядів іонів (не змінюється ступінь окиснення), то вони називаються іонообмін-ними.
Іонний добуток води. рН розчину
КH2O = 1.10-4. Дана константа для води називається іонним добутком води, який залежить тільки від температури. При дисоціації води на кожний іон Н+ утворюється один іон ОН-, тому в чистій воді кон-центрації цих іонів однакові: [Н+] = [ОН-]. Використовуючи значення іонного добутку води, знаходимо:
[H+] = [ОН-] =  моль/л.
моль/л.
Такі концентрації іонів Н+ і ОН- в чистій воді. Розглянемо, як зміниться концентрація при додаванні інших речовин, наприклад соляної кислоти, яка дисоціює у воді на іони Н+ і Сl-. Концентрація іонів Н+ в розчині стане зростати, але іонний добуток води від концентрації не залежить – в такому випадку змен-шується концентрація [ОН-]. Навпаки, якщо до води додати основу, то концентрація [ОН-] збільшиться, а [Н+] зменшиться. Концентрації [Н+] і [ОН-] взаємозв”язані: чим більше одна величина,тим менше інша, і навпаки. Кислотність розчинів звичайно виражають через концентрацію іонів Н+. В кислих розчинах [Н+] > 10-7 моль/л, в нейтральних [Н+] = 10-7 моль/л, в основних [Н+] < 10-7 моль/л. Щоб не писати числа з показником ступеню, кислотність розчину звичайно виражають через негативний логарифм концент-рації іонів водню, називаючи цю величину водневим показником: рН = -lg[Н+]. Величина рН вперше була введена данським хіміком С.Серенсоном. Літера „р” – початкова від данського слова potenz (ступінь), “Н” - символ водню. В кислих розчинах рН < 7, в нейтральних рН = 7, в основних pH > 7.
Гідроліз солей
Реакція чистої води є нейтральною (рН = 7). Водні розчини кислот і основ мають, відповідно, кислу (рН < 7) і основну (рН > 7) реакцію. Але, практика доводить, що не тільки кислоти і основи, а також солі можуть мати основну або кислу реакцію – причиною цього є гідроліз солей. Взаємодія солей з водою, в результаті якої утворюється кислота (або кисла соль), і основа (чи основна сіль), називається гідролізом солей. Розглянмо гідроліз солей наступних основних типів:
1. Солі сильної основи і сильної кислоти (наприклад KBr, NаNО3) при розчиненні у воді не гідролізуються, і розчин солі має нейтральну реакцію.
2. Солі сильної основи і слабкої кислоти, наприклад KClO, Nа2СО3, СН3СООNа, NаСN, Nа2S, К2SiO3.
Запишемо рівняння гідролізу ацетату натрія:
СН3СООNа + Н2О  СН3СООН +NaОН
СН3СООН +NaОН
В результаті реакції утворився слабкий електроліт – оцтова кислота. В іонному вигляді цей процес можна записати так:
СН3СОО- + Н2О  СН3СООН + ОН-
СН3СООН + ОН-
Таким чином, розчин СН3СООNа виявляє основну реакцію. При розчиненні солей багатоосновних кислот гідроліз проходить ступінчастно, наприклад: Nа2S + Н2О  NaНS + NаОН, або в іонній формі
NaНS + NаОН, або в іонній формі
S2- + Н2О  НS- + ОН-. (1)
НS- + ОН-. (1)
Процес (1) відображує гідроліз Nа2S по першому ступеню. Щоб гідроліз пройшов повністю, як правило, підвищують температуру процесу: НS- + Н2О  Н2S + ОН-. Таким чином, при розчиненні у воді солі сильної основи і слабкої кислоти, розчин придбає лужну реакцію внаслідок гідролізу.
Н2S + ОН-. Таким чином, при розчиненні у воді солі сильної основи і слабкої кислоти, розчин придбає лужну реакцію внаслідок гідролізу.
3. Солі слабкої основи і сильної кислоти, наприклад Аl2(SО4)3, FеСl2, СuВr2, NН4Сl.
Розглянемо гідроліз хлориду заліза (ІІ):
FeCl2 + H2O  Fe(OH)Cl + HCl. (2)
Fe(OH)Cl + HCl. (2)
В іонному вигляді цей процес можна записати:
Fe2+ + H2O  Fe(OH)+ + H+. (3)
Fe(OH)+ + H+. (3)
По другому ступеню гідроліз протікає наступним чином:
Fе(ОН)+ + Н2О  Fе(ОН)2↓ + Н+. (4)
Fе(ОН)2↓ + Н+. (4)
Із реакцій (2) – (3) ясно, що в результаті гідролізу солей слабкої основи і сильної кислоти розчин придбає кислу реакцію.
4. Солі слабкої основи і слабкої кислоти, наприклад Аl2S3, Cr2S3, СН3СООNН4, (NН4)2СО3.
При розчиненні таких солей у воді утворюються кислота і основа, що мало дисоціюють:
СН3СООNН4 + Н2О  СН3СООН + NН4ОН,
СН3СООН + NН4ОН,
або в іонному вигляді:
СН3СОO- + NН4+ +Н2О  СН3СООН + NН4ОН.
СН3СООН + NН4ОН.
Реакція середовища в розчинах подібних солей залежить від відносної сили кислоти і основи. Іншими словами, водні розчини таких солей можуть мати нейтральну, кислу або лужну реакцію в залежності від констант дисоціації кислот і основ, що утворюються. Так, при гідролізі СН3СООNН4 реакція розчину буде слаболужною, оскільки константа дисоціації гідроксиду амонія (К = 6,3∙10-5) дещо більше констан-ти дисоціації оцтової кислоти (К= 1,75∙10-5).
Задача 1. В лабораторії є розчин з масовою долею гідроксиду натрію 25%, щільність якого рівна 1,27 г/мл. Розрахуйте його об”єм, який треба змішати з водою, щоб отримати 500 мл розчину з масовою долею NаОН 8 % (щільність 1,09 г/мл).
Рішення. При рішенні задачі позначимо величини, що відносяться до вихідого розчину, індексом „1” (наприклад, m1 – маса вихідного розчину); величини, що відносяться до розчину, який треба приго-тувати, - індексом “2” (m2 – маса розчину, який треба приготувати); величини, однакові для обох розчинів, індекса мати не будуть.
Розраховуємо масу розчину NaOH, який треба приготувати: m2 = V2 · ρ2; m2 = 500 . 1,09 г = 545 г.
Визначаємо масу NaOH, яка буде міститись в розчині (така ж маса гідроксиду натрію повинна міститись і у вихідному розчині, яка буде розбавлена водою):
Розраховуємо масу розчину з ω1(NaOH) = 25%, в якому міститься гідроксид натрію масою 43,6 г:
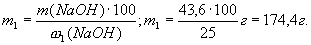
Об”єм вихідного розчину NaOH, який треба розбавити водою:
V1 =  ; V1 =
; V1 = 
Задача 2. Реакція протікає за рівнянням ЗВа2+ + 2РО43- = Ва3(РO4)2↓
Напишіть два різних рівняння в молекулярній формі, відповідаючих цій реакції.
Рішення. До іонів в лівій частині вихідного рівняння допишемо іони з протилежним значенням заряду з таким коефіціентом, щоб можна було співставити формули речовин. При цьому враховуємо, що вихідні речовини повинні достатньо добре розчинюватись у воді. Потім такі ж іони з такими ж коефіціентами пишемо в правій частині рівняння:
3Ва2++ 2РО43- = Ва3(РО4)2↓
6Cl- + 6Н+ = 6Сl- + 6Н+
Об”єднуючи іони обох рівностей в молекули, отримаємо рівняння реакції в молекулярній формі:
3ВаСl2 + 2Н3РО4 = Ва3(РО4)↓ + 6НСl
Аналогічно підбираємо і інші іони, які підходять до цього:
3Ва2+ + 2РО43- = Ва3(РО4)2↓
6NO3- + 6Na+ = 6NО3- + 6Na+
Отримаємо друге рівняння в молекулярній формі:
3Ba(NO3)2 + 2Nа3РО4 = Ва3(РО4)2↓+ 6NaNO3
Задача 3. Приймаючи, що сірчана кислота дисоціює повністю, визначте рН її 0,012 М розчину.
Рішення. Запишемо рівняння повної дисоціації сірчаної кислоти на іони:
H2SO4 2H+ + SO42-
2H+ + SO42-
Як бачимо, із 1 моль кислоти утворюється 2 моль Н+. Відповідно із 0,012 моль кислоти утворюється 0,024 моль Н+. Концентрація іонів водню в розчині буде дорівнювати 0,024 моль/л. Звідси:
рН = -lg[Н+]; рН = -lg 0,024 = 1,62.
Задача 4. Яку кількість барію треба взяти, щоб при його взаємодії з 1 л води утворився 2 %-ний розчин гідроксиду барію?
Рішення. Барій розчиняється у воді за рівнянням
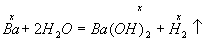
Якщо в реакцію вступило х моль Ва, то утворилось по х моль Ва(ОН)2 (М=171) і Н2. Маса речовини Ва(ОН)2 в розчині складає 171х, а маса розчину дорівнює:
m(р-ну) = 1000 + m(Ba) - m(Н2) = 1000 +137x – 2x = 1000+135x.
Масова доля гідроксиду барію рівна: ω(Ва(ОН)2) =171x / (1000 +135x) = 0,02, звідки х = 0,119.
Відповідь: 0,119 моль Ва.
Задача 5. Розрахуйте масові долі речовин в розчині, що уиворився при дії 25 мл 20%-ної кислоти (щільність 1,1 г/мл) на 4,0 г сульфіду заліза (II).
Рішення. Сульфід заліза (II) розчиняється в соляній кислоті за рівнянням
| 0,0455 | 0,091 | 0,0455 | 0,0455 | |||
| FeS | + | 2HCl | = | FeCl2 | + | H2S↑ |
m(р-ну НСl) = 25∙1,1 = 27,5 г. m(НСl) = 27,5∙0,2 = 5,5 г. v(НСl) = 5,5 / 36,5 = 0,151. v(FеS) = 4,0 / 88 = 0,0455.
FeS знаходиться в недостачі, і розрахунок за рівнянням реакції треба вести по FеS. В результаті реак-ції утворюється по 0,0455 моль FeСl2 (масою 0,0455∙127 = 5,78 г) і Н2S (масою 0,0455∙34=1,55 г), і вит-рачається 0,091 моль НСl. В розчині залишиться 0,151-0,091 = 0,06 моль НСl масою 0,06∙36,5 = 2,19 г.
Маса розчину, що утворився, дорівнює:
m(р-ну) = 27,5 + m(FеS) - m(Н2S) = 27,5 + 4,0 - 1,55 = 30,0 г.
Масові долі речовин в розчині:
ω(FеСl2) = 5,78 / 30,0 = 0,193, або 19,3%,
ω(НСl) = 2,19/ 30,0 = 0,073, або 7,3%.
Відповідь: 19,3% FеСl2, 7,3% НСl
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 3661; Нарушение авторских прав?; Мы поможем в написании вашей работы!