
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
ПН.20. Корозія та захист металів
|
|
|
|
Корозія металів (К.м.) – руйнування металів внаслідок фізико-хімічної дії зовнішнього середовища; при цьому метал переходить в окиснений (іонний) стан і втрачає притаманні йому властивості. Біля 10% щорічного видобутку металу втрачається на покриття незворотніх втрат внаслідок корозії і наступ-ного розпилення. Головний збиток від К.м. зв”язаний не тільки з втратою великої кількості металу, але і з виходом із строю самих металевих конструкцій, бо внаслідок корозії вони втрачають необхідну міц-ність, пластичність, герметичність,тепло- і електропровідність, відбивну здатність і інші необхідні якості.
Для більшості металів металевий стан є термодинамічно несталим. Прагнення металів переходити із металічного стану в іонний досить різне для різних металів і може бути, в загальному випадку, охара-ктеризоване по зменшенню вільної енергії при протіканні відповідної корозійної реакції в даних умовах. Таку характеристику по відношенню корозії металів у розчинах можна приблизно отримати на основі величини стандартного електрохімічного потенціалу металів. Корозійна стійкість металів чітко зв”язана з їх положенням в періодичній системі елементів.
Класифікація і механізм корозійних процесів. За механізмом корозійного процесу розрізняють два головних типи корозії: хімічну і електрохімічну.
Хімічна корозія – взаємодія металічної поверхні з оточуючим середовищем, що не супроводжу-ється виникненням електрохімічних (електродних) процесів на межі фаз. Механізм хімічної корозії зводиться до реактивної дифузії атомів або іонів металу скрізь плівку продуктів корозії (напр., окаліну), що поступово потовщується, та зустрічної дифузії атомів або іонів кисню. Цей процес має іонно-електронний механізм, аналогічний процесам електропровідності в іонних кристалах. Прикладом хімічної корозії є взаємодія металу з рідкими неелектролітами або сухими газами в умовах, коли волога на поверхні металу не конденсується, а також дія на метал рідких металевих розплавів.
Практично найбільш важливим видом хімічної корозії є взаємодія металу при високих температурах з киснем і іншими газоподібними активними средовищами (H2S, SO2, CO2, галогени, водяні пари і ін.). Такі процеси хімічної корозії також мають назву газової корозії. Багато відповідальних деталей інже-нерних конструкцій сильно руйнуються від газової корозії (лопатки газових турбін, сопла ракетних дви-гунів, елементи електронагрівачів, колосники, арматура печей). Великі втрати від газової корозії (угар металу) несе металургійна промисловість. Причина газової корозії металів – їх термодинамічна нестій-кість в даному газовому середовищі при певних зовнішніх умовах (температурі і тиску).
Найбільш поширений приклад газової корозії – процес взаємодії металу з киснем:
 Ме + ½ О2 МеО
Ме + ½ О2 МеО
Напрям хімічної реакції окиснення металів визначається парціальним тиском кисню в газовій суміші (РО2) і тиском дисоціації при даній температурі (РМеО). Розглянемо можливі шляхи протікання цієї хіміч-ної реакції:
а) РО2 = РМеО, тобто парціальний тиск кисню РО2 і тиск дисоціації оксиду РМеО рівні; реакція знаходиться у рівновазі;
б) РО2 > РМеО, реакція зміщена в бік утворення оксиду;
в) РО2 < РМеО, реакція протікає в зворотньому напряміц; оксид буде дисоціювати на чистий метал і кисень.
Швидкість процесу газової корозії залежить від ряду факторів: природи металу (склад сплаву), характеру газового середовища і його температури, від властивостей продуктів корозії, часу контакту газового середовища з об”єктом дії. Від властивостей і характеру оксидної плівки (продуктів корозії), що утворюється на поверхні металу, залежить процес корозії. Механізм утворення подібної плівки:
1. Адсорбція молекул кисню поверхнею металу, що контактує із атмосферою
2. Хімічна взаємодія металу і газу з утворенням хімічної сполуки.
В результаті такої взаімодії утворюється спочатку мономолекулярний, а потім полімолекулярний шар оксидів. В подальшому атоми кисню дифундують через шар оксиду, що утворився; одночасно з цим в протилежному напрямі від нього дифундують іони металу. Реагуючи з киснем, іони металу утворюють оксид, що призводить до появи нових шарів плівки, тобто до її потовщення. По мірі потовщення процес дифузії буде утруднюватись. Виникаюча плівка буде гальмувати подальший розвиток корозійного про-цесу лише в тому випадку, коли вона буде мати захисні властивості. В зв”язку з цим важливо знати властивості виникаючих плівок, механізм і закони їх зросту, відношення плівок до впливу різних зовніш-ніх факторів (температури, рН середовища, тиску і т.д.). Розрізняють три групи плівок, виникаючих на металі, в залежності від їх товщини:
1) тонкі (невидимі) з товщиною менше 400 Å
2) середні (що дають пагінцеві кольори – рос.: „ цвета побежалости ”), товщина яких 400 – 5000 Å
3) товсті (видимі) – товщина більше 5000 Å.
Щоб оксидна плівка була захисною, вона має задовольняти таким вимогам: бути суцільною, безпо-ристою; мати добре зчеплення з металом; мати коефіціент термічного розширення, близький до цієї характеристики металу; бути хімічно інертною по відношенню до даного агресивного середовища; бути твердою і стійкою до зношення.
Закони зросту оксидних плівок на поверхні металів. Процеси газової корозії – це багатостадійні гетерогенні процеси, що протікають на межі розділу фаз метал – газове середовище. В процесі взаємо-дії металу з газоподібними речовинами, який супроводжується утворенням пористої оксидної плівки на поверхні металу, можна виділити такі послідовні стадії:
а) транспортування газоподібних речовин до поверхні розділу фаз
б) адсорбція газу на поверхні металу
в) хімічна взаємодія
г) відвід (десорбція, сублімація) продуктів корозії із зони взаємодії (в деяких випадках).
При утворенні незахисної плівки (пористої) найбільш повільною (лімітуючою) стадією процесу є хімічна взаємодія; товщина плівки при цьому прямо пропорційна часу. При утворенні на поверхні металу захисної (суцільної, непористої) плівки схему процесу можна розбити на такі стадії:
а) перехід металу в формі іонів і електронів із металічної фази в оксид:
 Ме (тв) Ме n + + ne-
Ме (тв) Ме n + + ne-
б) переміщення іонів металу і електронів в оксидному шарі
в) транспортування кисню до поверхні розділу оксидна плівка – газ
г) адсорбція кисню на поверхні оксидної плівки
д) іонізація адсорбованого кисню
ж) переміщення іонів кисню в оксидному шарі
з)хімічна взаємодія з утворенням оксиду.
Газова корозія заліза, сталі, чавуну і інших металів і сплавів. При нагріванні вище 600 оС залізо і вуглецева сталь покриваються плівкою – окалиною, що має складну будову. Товщина шару різних оксидів залежить від температури, часу корозії і складу газового середовища. Найбільш близький до заліза шар оксиду заліза (ІІ) має кращі захисні властивості. Останні шари мають пори і тріщини і легко відшаровуються. У сталі поряд з окисненням заліза відбувається взаємодія карбіду заліза з киснем повітря і кисне-вміщуючими речовинами:
 Fe3C + O2 3Fe + CO2
Fe3C + O2 3Fe + CO2
 Fe3C + CO2 3Fe + 2CO
Fe3C + CO2 3Fe + 2CO
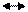 Fe3C + H2O 3Fe + CO + H2
Fe3C + H2O 3Fe + CO + H2
В результаті, поверхневий шар збіднюється карбоном, що призводить до змін в структурі сплаву і погіршує його механічні і антикорозійні властивості. Вміст домішок марганцю, сірки, фосфору не вияв-ляє помітного впливу на корозію сталі.
Сталь і чавун декарбонізуються також в середовищі водню із утворенням метану:
t, p
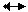 Fe3C + 2H2 3Fe + CH4
Fe3C + 2H2 3Fe + CH4
Цей вид корозії, що також називається водневою, спостерігається при взаємодії водню з залізо-вуглецевими сплавами при високих температурах і тисках, наприклад в колонах синтезу аміаку (цей процес ведуть при 450-550 оС і тиску 25-100 МН/м2). Для попередження декарбонізації сталі при висо-ких температурах застосовують леговані сталі. В якості легуючих домішок вводять елементи, які здатні утворювати карбіди, більш стійкі по відношенню до водню, ніж цементит Fe3C.
Карбонільна корозія - процес руйнування металів при взаємодії їх з оксидом вуглецю (ІІ), який при високих тисках і температурах (як, наприклад, в процесах отримання синтетичних спиртів – метило-вого, бутилового і ін.) може утворювати з металами карбоніли, що легко сублімуються:
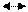 Ме + n СО Ме(СО) n
Ме + n СО Ме(СО) n
Для заліза реакція йде з утворенням пентакарбонілу заліза:
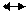 Fе + 5 (СО) Fе(СО) 5
Fе + 5 (СО) Fе(СО) 5
Fе(СО) 5 - рідина, що кипить при 102 оС, її пари повністю дисоціюють на Fе і СО при тиску 0,1 МН/м2 і температурі вище 140 оС.
При карбонільній корозії відбувається руйнування поверхневого шару металу і розпушення його на глибину до 5 мм. В якості попереджувальних мір до складу сталі вводять легуючі домішки. Але, треба мати на увазі, що нікель при взаємодії з оксидом карбону (ІІ) утворює легкокиплячий тетракарбоніл нікелю Ni(CO)4. Не піддаються карбонільній корозії хромисті сталі з вмістом 30% Cr, хром-нікелеві сталі (23% Cr, 20% Ni) та марганцовисті бронзи при температурі до 700 оС і тиску до 35 МН/м2.
 Корозії під дією хлору і хлороводню піддаються практично всі метали і сплави. Хлориди металу типу MeCl2 і MeCl3, що при цьому утворюються, плавляться або розкладаються при підвищенні температури Реакція взаємодії Ме + СІ2 МеСІ2 носить екзотермічний характер і, оскільки при цьому швидкість тепловідводу може бути нижче швидкості реакції, то метали в потоці хлору горять, чим цей вид корозії принципово відмінний від дії інших газових средовищ. Найбільш стійкі по відношенню до хлору і хлоро-водню нікель, хромонікелеві сталі, свинець. Пояснюється це тим, що взаємодія цих металів з хлором не супроводжується екзотермічним ефектом і плівки, що утворюються, мають захисні властивості.
Корозії під дією хлору і хлороводню піддаються практично всі метали і сплави. Хлориди металу типу MeCl2 і MeCl3, що при цьому утворюються, плавляться або розкладаються при підвищенні температури Реакція взаємодії Ме + СІ2 МеСІ2 носить екзотермічний характер і, оскільки при цьому швидкість тепловідводу може бути нижче швидкості реакції, то метали в потоці хлору горять, чим цей вид корозії принципово відмінний від дії інших газових средовищ. Найбільш стійкі по відношенню до хлору і хлоро-водню нікель, хромонікелеві сталі, свинець. Пояснюється це тим, що взаємодія цих металів з хлором не супроводжується екзотермічним ефектом і плівки, що утворюються, мають захисні властивості.
Стійкість проти газової корозії підвищується при введенні в склад сплаву різних домішок – хрому, алюмінію, кремнію і др.. Наприклад, сталь із вмістом 25% Cr, 20% Ni, 1% Mn, 0,15% C і до 1% Si є жа-ростійкою (до 900-950 оС), а при наявності в сталі 30% Cr і 4-5% Al вона витримує температуру 1100-1150 оС. Домішки алюмінію, бурилію і магнію до міді підвищують її опір газовій корозії в окиснюваль-ному середовищі. Для захисту залізних і стальних виробів від газової корозії поверхню виробу покри-вають алюмінієм (алітирування).
На малюнку приведена схема хімічного (А) і електрохімічного (В) корозіонного процесу.
 О2
О2
 |
|
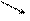
|

 О2
О2
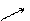
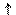

|

 Ме 2 О Ме++ х Н2О
Ме 2 О Ме++ х Н2О
А В
Під електрохімічною корозією (Е.к.) розуміють процеси взаємодії металів з електролітами (у ви-гляді водних розчинів; іноді з неводними електролітами, наприклад з деякими органічними електропро-водними сполуками, або безводними розплавами солей пр підвищених температурах). Процеси елект-рохімічної корозії протікають за законами електрохімічної кінетики, коли загальна реакція взаємодії може бути розділена на наступні, доволі самостійні, електродні процеси: а) анодний процес – перехід металу в розчин у вигляді іонів (в водних розчинах, звичайно гідратованих), б) катодний процес – аси-міляція надлишкових електронів, що з”явились в металі, якими-небудь деполяризаторами.
Для протікання Е.к. необхідний контакт металу з розчином електроліту. У водному середовищі меха-нізм процесу Е.к. подібний процесу, що має місце в елементі батареї для кишенькового ліхтаря.
 | |||||
| |||||
 | |||||
 1
1
 |
 2
2
 |  |
 3
3
Принципова схема
сухого елементу:
1 – вугільна пластина,
2 – цинк, 3 – розчин
електроліту
Під час роботи мікрогальванічного елементу одночасно протікають два електродних процеси:
1. Анодний – процес переходу іонів металу в розчин із залишенням відповідної кількості електронів на поверхні металу:
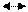 Ме+е- + n Н2О Ме+ + n Н2О + е-
Ме+е- + n Н2О Ме+ + n Н2О + е-
Прикладами таких процесів можуть бути реакції окиснення:
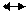 Zn Zn2+ + 2e-
Zn Zn2+ + 2e-
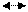 Al Al3+ + 3e-
Al Al3+ + 3e-
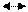 Fe2+ Fe3+ + e-
Fe2+ Fe3+ + e-
2. Катодний процес – асиміляція надлишкових електронів атомами або молекулами електроліту (депо-ляризаторами), які при цьому відновлюються. Прикладами катодних процесів є реакції відновлення:
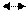 H+ ½ H2 – e-
H+ ½ H2 – e-
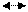 Cu2+ Cu – 2 e-
Cu2+ Cu – 2 e-
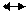 Fe3+ Fe2+ – e-
Fe3+ Fe2+ – e-
Обидва вказаних процеси відбуваються у спряженості і уповільнення одного з них призводить до гальмування іншого. Руйнування (корозія) металів звичайно відбувається на аноді.
Поляризація, деполяризація. Деякі метали (магній, алюміній) з термодинамічної точки зору корозійно-нестійкі, але на практиці в певних умовах вони кородують повільно і можуть застосовуватись в якості конструкційних матеріалів. Щоб правильно оцінювати вплив різних факторів на швидкість корозії, необхідно мати дані про рівноважний стан системи і враховувати те, що при протіканні струму через електрод його стан рівноваги порушується. Протікання електричного струму при роботі корозійного мікроелементу обумовлене початковою різницею потенціалів катоду і аноду, потенціал цього елект-роду змінюється в залежності від величини і напряму зовнішнього струму.
Вивчення механізму і розробка теорії процесів електрохімічної корозії металів в значній мірі засно-вані на загальних законах електрохімічної кінетики і, зокрема, на вивченні електродних потенціалів, кінетики електродних реакцій і загальних законів роботи корозійних гальванічних елементів.
Для процесів електрохімічної корозії величина корозійного струму (прямо пропорційного швидкості корозії) визначається вираженням:
I = (V0K – V0A) / (PK + PA + R)
де (V0K – V0A) – різниця початкових потенціалів (катодного деполяризуючого процесу V0K і анодної реакції розчинення металу V0A) в умовах корозії. Знаменник даного виразу, що представляє собою загальне кінетичне гальмування системи, виражається наступними величинами, що визначають омічну розмірність: середньою катодною (PK) і анодною (PA) поляризуємістю, які характеризують кінетику катодного і анодного процесів, і загальним омічним опором системи (R).
Величина корозійного струму після замкнення ланцюгу швидко падає і через деякий час стає постій-ною. Так як величина омічного опору в такому випадку мала і постійна, то зменшення сили корозійного струму можна пояснити лише зміщенням початкових значень потенціалів, тобто зменшенням їх різниці. Така зміна потенціалів в результаті протікання струму називається поляризацією, а речовини, що змен-шують поляризацію – деполяризатори. Зменшення поляризованості електродів називається деполя-ризацією.
Для вивчення швидкості і характеру електродних процесів вимірюють потенціал електроду в залеж-ності від щільності струму, що через нього проходить, отримуючи при цьому анодні або катодні поляри-заційні характеристики. Графіки такого функціонального зв”язку широко використовують при вивченні процесів електрохімічної корозії.
Анодна поляризація. В залежності від причин, що визивають анодну поляризацію, розрізняють три основні випадки. Концентраційна поляризація – цей вид анодної поляризації викликається невеликою швидкістю дифузії іонів металу в розчині електроліту, із-за чого виникає підвищена концентрація іонів в прианодній зоні.
Перенапруження іонізації металу. Якщо при протіканні анодного процесу
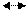 Ме+е- + n Н2О Ме+ + n Н2О + е-
Ме+е- + n Н2О Ме+ + n Н2О + е-
вихід іонів металу не встигає за відводом електронів, потенціал металу зміщується в позитивний бік.
Анодна пасивність, яка міститься в утворенні пасивних плівок на поверхні металу. Анодний процесс завдяки явищу анодної пасивності різко гальмується. Цим можна пояснити достатньо високу корозійну стійкість алюмінію і нержавіючих сталей в розчинах азотної кислоти і в аерованих розчинах солей. За-хисні фазові плівки на аноді можуть утворюватись як результат відкладення на поверхні металу важко-розчинюваних сполук цього металу.
 Катодна поляризація. Ця поляризація обумовлюється перенапруженням катодної реакції, тобто уповільненням процесу D + n e- Dne -; концентраційною поляризацією, тобто недостатньою швидкістю підводу або відводу початкових або кінцевих продуктів реакції на катоді. В залежності від того, відбувається катодна деполярізація в основному за рахунок розрядів іонів водню, іонізацією роз-чиненого у розчині кисню або відновленням яких-небудь окиснювачів, розрізняють корозію з водневою, кисневою або окислювальною деполяризацією.
Катодна поляризація. Ця поляризація обумовлюється перенапруженням катодної реакції, тобто уповільненням процесу D + n e- Dne -; концентраційною поляризацією, тобто недостатньою швидкістю підводу або відводу початкових або кінцевих продуктів реакції на катоді. В залежності від того, відбувається катодна деполярізація в основному за рахунок розрядів іонів водню, іонізацією роз-чиненого у розчині кисню або відновленням яких-небудь окиснювачів, розрізняють корозію з водневою, кисневою або окислювальною деполяризацією.
Можливі наступні основні види катодної деполяризації:
а) деполяризація іонами

 б) розряд катіонів (іонів водню або благородних металів): H+ + e- H ½ H2
б) розряд катіонів (іонів водню або благородних металів): H+ + e- H ½ H2
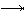 Ag+ + e- Ag
Ag+ + e- Ag
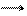 в) відновлення нейтральних молекул: O2 + 4e- + 2H2O 4OH-
в) відновлення нейтральних молекул: O2 + 4e- + 2H2O 4OH-
 Cl2 + 2e- 2 Cl-
Cl2 + 2e- 2 Cl-
Найбільш часті випадки корозії в практиці – це процеси, які протікають в розчинах неокислюваль-них кислот з виділенням водню – воднева деполяризація, або в нейтральних розчинах солей. Іноді обидва ці процеси проходять паралельно. Процес розряду іонів водню на катоді представляють у вигляді схеми, що складається із декількох стадій:
1. Дифузія і міграція гідратованих іонів водню до катоду: Н+. Н2О = (Н3О)+
 2. Дегідратація іонів водню: (Н3О)+ Н+ + Н2О
2. Дегідратація іонів водню: (Н3О)+ Н+ + Н2О
3. Входження іону водню до складу подвійного шару.
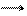 4. Розряд іону водню: Н+ + е- Надс
4. Розряд іону водню: Н+ + е- Надс
5. Рекомбінація атомів водню у молекулу: Надс + Надс = Н2
6. Утворення і відрив пухирців із молекул водню від поверхні катоду.
Корозія металів з кисневою деполяризацією (в основному, при наявності кисню в розчині). Як люба електрохімічна гетерогенна реакція, цей процесс протікає в дві стадії.
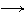 Для кислих розчинів: О2 + 4 Н+ + 4 е- 2 Н2О
Для кислих розчинів: О2 + 4 Н+ + 4 е- 2 Н2О
Для нейтральних і лужних середовищ сумарна реакція кисневої деполяризації описується так:
 О2 + 2 Н2О + 4 е- 4 ОН-
О2 + 2 Н2О + 4 е- 4 ОН-
Наступні види електрохімічної корозії протікають з кисневою деполяризацією: атмосферна, у воді (морській, прісній), в нейтральних розчинах солей, в аерованих розчинах слабких органічних кислот; грунтова, в розплав солей і т.д.
Анодна і катодна реакції металу класифікуються як первинні процеси корозії, а продукти корозії називаються первинними продуктами корозії.
В процесі електрохімічної корозії можливе протікання вторинних процесів: взаємодія первинних продуктів корозії одне з одним, з електролітом, з розчиненими в ньому газами із утворенням вторинних продуктів корозії. Найбільший інтерес викликає утворення плівок важкорозчинних сполук (наприклад гідроксидів, фосфатів і др.). В загальному випадку слаборозчинні вторинні продукти корозії затрудяють доступ електроліту до поверхні металу і тим самим знижають швидкість електрохімічної корозії.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1210; Нарушение авторских прав?; Мы поможем в написании вашей работы!