
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Определение карбонатной жесткости
|
|
|
|
Ход анализа. Ополоснуть мерную колбу на 100 мл два-три раза анализируемой водой. Наполнить ее этой водой до метки. Всю воду из колбы количественно перенести в коническую колбу. Прибавить 1—2 капли раствора метилового оранжевого. Оттитровать рабочим раствором НС1 до появления неисчезающей бледно-розовой окраски. Кислота нейтрализует лишь гидрокарбонаты кальция и магния: Са(НСО3)2 + 2НС1 = СаС12 + 2СО2 + 2Н20 Мg(НСО3)2 + 2НС1 = МgС12 + 2СО2 + 2Н20 Количество израсходованной на титрование кислоты эквивалентно количеству солей, определяющих карбонатную жесткость титруемой воды. Так как нормальность раствора означает число грамм-эквивалентов растворенного вещества в 1 л или число миллиграмм-эквивалентов в 1 мл, то произведение нормальности раствора соляной кислоты на число миллилитров ее, израсходованное на титрование, равно числу миллиграмм-эквивалентов солей, обусловливающих жесткость и содержащихся в 100 мл воды. Для определения карбонатной жесткости полученный результат следует увеличить в 10 раз. Карбонатную жесткость (временную) можно вычислить по формуле: ЖК=VHCl×NHCl×10 Пример. На титрование 100 мл анализируемой воды в присутствии метилового оранжевого израсходовали 3,40 мл 0,09880 н. НС1. ЖК =3,40×0,09880×10 =3,36 мг-экв/ л. При титровании 100 мл воды точно 0,1 н. кислотой (например, приготовленной из фиксанала) жесткость воды численно равна числу миллилитров кислоты, израсходованной на титрование.
Определение рН в природной воде потенциометрическим методом
Метод основан на измерении разности потенциалов, возникающих на границах между внешней поверхностью стеклянной мембраны электрода и исследуемым раствором, с одной стороны, и внутренней поверхностью мембраны и стандартным раствором - с другой. Внутренний стандартный раствор стеклянного электрода имеет постоянную активность ионов водорода, поэтому потенциал на внутренней поверхности мембраны не меняется. Сдвиг рН на единицу вызывает изменение потенциала электрода на 58,1 мВ при 20 °С.
Потенциометрический метод определения рН воды отличается большой точностью (до 0,02). Определению не мешают окраска, мутность, свободный хлор окислители, восстановители, повышенное содержание солей.
Приборы и реактивы
1. Потенциометры (рН-метры) любой модели со стеклянным и каломельным (или хлорсеребряным) электродом. Стеклянный электрод перед работой выдерживают 8 ч в 0,01 н. растворе хлористоводородной кислоты. Перед измерением его несколько раз ополаскивают дистиллированной водой. Стеклянный электрод должен быть прокалиброван по буферным растворам.
2. Термометр с ценой деления 0,1 °С
Реактивы. Для приготовления буферных растворов применяют бидистил-лированную воду, лишенную углекислоты (свежепрокипяченную и охлажденную).
1. Бифталатный буферный раствор, рН 4 при 20 °С. 2.Фосфатный буферный раствор, рН 6,88 при 20 °С. З.Тетраборатный буферный раствор, рН 9,22 при 20 °С. Хранят буферные растворы в плотно закрытых полиэтиленовых бутылках в прохладном месте.
2. Проведение анализа
Перед включением прибора проверяют его «механический нуль», и при необходимости его корректируют. Включают рН-метр, после прогрева корректируют «электрический нуль». Затем проверяют и устанавливают шкалу по 2— 3 буферным растворам. Для этого стаканчик с буферным раствором помещают под стеклянный и хлорсеребряный электроды так, чтобы раствор полностью покрывал шарик стеклянного электрода. Нижний конец хлорсеребряного электрода должен быть ниже шарика стеклянного электрода. В стаканчик помещают термометр.
На поверхности шарика не должно быть пузырьков воздуха. Измеряют рН буферного раствора, спустя 2—3 мин повторяют измерение. Если оба значения совпадают, то потенциал электрода считают установившимся и приступают к коррекции шкалы в соответствии с инструкцией. Затем аналогично поступают с другими буферными растворами. Электрод между измерениями тщательно ополаскивают дистиллированной водой, снимают капли ее чистой фильтровальной бумагой и ополаскивают 2 раза небольшими порциями нового буферного раствора.
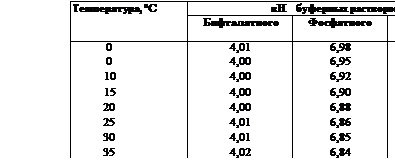 |
После проверки и коррекции прибора электроды, термометр и стаканчик тщательно ополаскивают дистиллированной водой, а затем исследуемой водой. Наливают в стакан анализируемую воду и измеряют рН 2-3 раза с интервалом 2-3 мин. Последние два показания прибора должны быть одинаковыми. Если исследуемая вода имеет низкую температуру (около 0° С), то её нужно нагреть до комнатной температуры иначе стрелка рН-метра будет «плыть», пока не установится комнатная: температура.
Контрольные вопросы и задачи.
1. Что такое общая жесткость? Какие ионы вносят основной вклад.
2. В каких единицах измеряется жесткость воды? Интервалы питьевой воды по содержанию элементов жесткости.
3.Объяснить изменение цвета раствора при титровании пробы воды раствором ЭДТА.
4. Как определяют общую жесткость воды?
5.Как определяют карбонатную жесткость воды?
6. Как находят некарбонатную жесткость воды?
7. Особенности индикаторов в комплексонометрии.
8. Физико-химические методы снижения жесткости воды
Задачи:
1. На титрование 200 мл Н20 израсходовано 8 мл 0,1 н. раствора комплексона III. Вычислите общую жесткость воды. Ответ: 2 ммоль/л.
2. Определите карбонатную жесткость, если на титрование 200 мл Н20 израсходовано 8 мл 0,05 н. раствора НС1. Ответ: I ммоль/л.
3. Вычислите общую, карбонатную и некарбонатную жесткость воды, если:
а) на титрование 200 мл Н20 израсходовано 7,6 мл 0,05 н. комплексона III;
б) на титрование 100 мл Н20 - 1,5 мл 0,1 н. НС 1. Ответ: 0,95; 0,75; 0,2 ммоль/л
Методический инструментарий преподавателя:
-активные формы: фронтальный опрос.
Средства контроля: Тест № (см. фонд оценочных средств)
Содержание внеаудиторной работы бакалавра при подготовке к занятию
1. Владеть содержанием вопросов (по лекции).
2. Законспектировать вопрос проблемы пресной воды.
3. Подготовиться к диагностической самостоятельной работе в форме опроса и теста
4. Изучить термины по данной теме
Литература
1. Голдовская Л.Ф. Химия окружающей среды. - М.: МИР, 2005. - 294 с. (Библиотека УлГПУ)
2. Гусакова Н.В. Химия окружающей среды: учебное пособие для вузов. - Ростов на Дону: Феникс, 2004. - 84 с. (Библиотека УлГПУ)
3. Голицын А.Н. Промышленная экология и мониторинг загрязнения природной среды. - М.: ОНИКС, 2010. - 336 с. (Электронный ресурс.- Режим доступа: http://www.knigafund.ru/books/42468)
4. Хентов В.Я. Химия окружающей среды для технических вузов: учеб. пособие. - Ростов на Дону: Феникс, 2005. – 141 с. (Библиотека УлГПУ)
5. Тарасова Н. П. Химия окружающей среды. Атмосфера: учеб. пособие для вузов. - М.: Академ.книга, 2007. - 227 с. (Библиотека УлГПУ).
Лабораторная работа №3 (2часа)
Измерение массовой концентрации общего железа с сульфосалициловой кислотой (фотоколориметрия (ГОСТ 4011-72), комплексонометрия)
Цель
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1013; Нарушение авторских прав?; Мы поможем в написании вашей работы!