
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Определение нитритов
|
|
|
|
Уметь
Знать
Требования к умениям бакалавров
Формирование знаний о основных приемах анализа параметров гидросферы, литосферы
Определение биогенных элементов
Цель
2. Систематизация знаний о физико-химических методах анализа
3. Формирование знаний по оценке современного состояния отдельных геосфер или их частей, прогноза изменения их состояния в условиях антропогенного воздействия, разработки мероприятий по снижению уровня воздействия на геосферы или их составные части.
4. способность организовывать сотрудничество обучающихся, поддерживать активность и инициативность, самостоятельность обучающихся, их творческие способности» (ПК-7).
Содержание
Проведение анализа воды из различных источников (водопроводная вода, родниковая вода, речная вода)
Обработка результатов анализа
Формулирование выводов
Работа с вопросами и расчетными задачами
Основы метода фотоколориметрии
Термины
Технику безопасности при работе в химической лаборатории
Негативное влияние примесей в воде на биоту
Решать задачи по соответствующему разделу
Проводить количественный анализ
Использовать нормативно-техническую документацию
Использовать физико-химические методы при анализе проб
К биогенным элементам, т.е. элементам, жизненно необходимым для биологической продуктивности водоема, прежде всего относят кремний, азот, фосфор определение которых предусмотрено прежде всего ГОСТом.
Методы определения. Реакция взаимодействия диазонитрованной в присутствии нитритов сульфаниловой кислоты с ароматическими аминами является одной из самых чувствительных реакций, с помощью которых могут быть обнаружены очень малые (единицы мкг/л) количества нитритных ионов.
Отбор, предварительная обработка, хранение проб. Нитритные ионы - неустойчивые вещества, определение которых должно производиться вскоре после отбора. Пробы предварительно фильтруют через мембранный фильтр 0,45 мкм. Если анализ не может быть выполнен немедленно, пробу консервируют добавление 2-4 мл хлороформа на 1 л воды и хранят при температуре 3-5о С в течение 1-3 суток.
ФОТОМЕТРИЧЕСКИЙ МЕТОД С РЕАКТИВОМ ГРИССА
1. Назначение метода. Метод применим для определения нитритов в поверхностных водах с содержанием от 0,007 до 0,35 мг N/л.
2. Принцип метода. Метод основан на способности первичных ароматических аминов в присутствии азотистой кислоты давать интенсивно окрашенные диазосоединения. Оптическую плотность образованного диазосоединения определяют при λ=536 нм. Линейная зависимость между оптической плотностью растворов и концентрацией нитритов сохраняется в пределах от 0,007 до 0,350 мг N/л.
3. Приборы и реактивы Реактив Грисса. Сухой готовый реактив Грисса, х.ч., предварительно растертый в ступке до однородной массы. Стандартные растворы азотнокислого натрия NaNO2, х.ч.: а) запасной стандартный раствор 250 мг мг N/л. 0,6157 г высушенного
при 110о С и охлажденного в эксикаторе над хлористым кальцием нитрита
натрия растворяют в мерной колбе на 500 мл дистиллированной водой. Хранят при температуре 3-5о С в течение нескольких недель. б) рабочий стандартный раствор, 5 мг N/л. 5 мл запасного стандартного раствора разбавляют в мерной колбе на 250 мл дистиллированной водой.
Готовят перед употреблением. Спектрофотометр или фотоэлектроколориметр (зеленый светофильтр, λ=536 нм). Колбы мерные: 500 мл - 1 шт.; 250 мл - 1 шт.; 200 мл - 1 шт.; 50 мл - 10 шт., колбы конические: 100 мл - 10 шт., пипетки: 1 мл1 шт.; 2 мл1 шт; 5 мл2 шт., склянки для реактивов: 4 шт.,цилиндры: 25 мл - 1 шт.; 200 мл 2 шт., скальпель: 1 шт.
4. Характеристики метода. Минимальная определяемая концентрация 0,007 мг N/л. Относительное стандартное отклонение U при концентрациях от 0,080 до 0,300 мг N/л составляет 2% (n=30), при концентрациях < 0,080 мг N/л - 10%. продолжительность определения единичной пробы 50 мин.
5. Мешающие влияния. Определению мешают сильные окислители и восстановители в концентрациях, редко встречающихся в природных водах.
6. Проведение анализа. 50 мл исследуемой пробы помещают в коническую колбу на 100 мл, добавляют около 0,1 г сухого реактива Грисса (на кончике скальпеля) или 2,5 мл его раствора и тщательно перемешивают. Через 40 мин. (по секундомеру) измеряют оптическую плотность раствора на фотоэлектроколориметре (зеленый светофильтр) в кюветах с толщиной слоя 1 см против дистиллированной воды. При низких концентрациях нитритов (0,007- 0,05 мг мг N/л) целесообразно использовать кювету с толщиной слоя 5 см (в этом случае при построении калибровочной кривой также используют кюветы с толщиной слоя 5 см). Одновременно производят определение оптической плотности исследуемой пробы воды без добавления реактивов. Ее значение вычитают из оптической плотности пробы. Содержание нитритов в мг N/л находят по калибровочной кривой.
7. Построение калибровочной кривой. В мерные колбы емкостью 50 мл приливают 0; 0,1; 0,2; 0,4; 0,8; 1,0; 1,5; 2,0; 3,0 мл рабочего раствора и доводят объем до метки дистиллированной водой. Концентрации этих растворов соответственно равны: 0; 0,01; 0,02; 0,04; 0,08; 0,10; 0,15; 0,20; 0,30 мг N/л. Производят определение, как описано выше. Оптическую плотность растворов измеряют против дистиллированной воды. Строят калибровочную кривую, откладывая по оси абсцисс концентрацию нитритов в мг N/л, по оси ординат - оптическую плотность.
8. Обработка результатов. Содержание нитритов Сх в мг N/л рассчитывают по формуле
Сх = С∙ n,
где С - концентрация нитритов, найденная по калибровочной кривой в мг N/л; n - степень разбавления исходной пробы воды (в случае если исследуемую пробу не разбавляют, n = 1; если взято 10 мл и разбавлено до 50 мл, n = 5 и т.д.)
Определение содержания полифосфатов
Метод основан на гидролизе полифосфатов в кислой среде, при котором они переходят в растворенные ортофосфаты, определяемые колориметрическим методом в виде фосфорномолибденового комплекса, окрашенного в синий цвет. В отдельной пробе определяют ортофосфаты, первоначально бывшие в воде, содержание которых вычитают из результата, полученного при определении полифосфатов. Чувствительность метода составляет - 0,01 мг/л.
1. Методы отбора проб
1.1. Пробы воды отбирают по ГОСТ 2874-73 и ГОСТ 4979-49.
1.2. Объем пробы воды для определения содержания полифосфатов должен быть не менее 500 мл.
1.3. Пробы воды отбирают в хорошо выщелоченные склянки с притертыми пробками.
1.4. Если анализ в день отбора пробы не произведен, воду консервируют добавлением 2 - 4 мл хлороформа на 1 л воды.
2. Приборы и реактивы
Фотоэлектроколориметр, кюветы с толщиной рабочего слоя 2 - 3 см., термостат с регулятором температуры, плитка электрическая, фильтр бумажный (синяя лента), посуда мерная лабораторная стеклянная по ГОСТ 1770-74 и ГОСТ 20292-74 вместимостью: колбы мерные 50, 100 и 1000 мл, пипетки мерные 1 - 2 мл с делениями 0,01 мл, 5 - 10 мл с делением 0,1 мл; пипетки мерные 5, 10, 20, 50 и 100 мл без делений, стаканы стеклянные лабораторные по ГОСТ 10394-72, аммоний молибденовокислый по ГОСТ 3765-72, калий фосфорнокислый однозамещенный по ГОСТ 4198-75, кислота соляная по ГОСТ 3118-67, кислота серная по ГОСТ 4204-66, олово двухлористое по ГОСТ 36-68, кислота сульфаминовая, вода дистиллированная по ГОСТ 6709-72. Вся посуда должна быть обработана горячей соляной кислотой и тщательно промыта дистиллированной водой. Все реактивы должны быть квалификации ч. д. а.
3. Подготовка к анализу
3.1. Приготовление основного стандартного раствора однозамещенного фосфорнокислого калия. 7165 г KH2PO4, х. ч., предварительно высушенного в термостате в течение 2 ч при 105 °C, растворяют в мерной колбе вместимостью 1000 мл дистиллированной водой и доводят объем раствора до метки, добавляют 2 мл хлороформа.
1 мл раствора содержит 0,5 мг РО3-4.
3.2. Приготовление I рабочего стандартного раствора однозамещенного фосфорнокислого калия. 10 мл основного раствора доводят до 1 л дистиллированной водой, 1 мл раствора содержит 0,005 мг РО3-4. Необходимо применять свежеприготовленный раствор.
3.3. Приготовление II рабочего стандартного раствора однозамещенного фосфорнокислого калия. 50 мл I рабочего раствора доводят до 250 мл дистиллированной водой. 1 мл раствора содержит 0,001 мг РО3-4. Необходимо применять свежеприготовленный раствор.
3.4. Приготовление молибденовокислого аммония (реактив I, кислый раствор)
25 г (NH4)6 · Мo7О24 · 4Н2O растворяют в 600 мл дистиллированной воды. К этому раствору осторожно, охлаждая, добавляют 337 мл концентрированной 98 %-ной серной кислоты. После охлаждения раствор доводят дистиллированной водой до 1 л. Раствор хранят в бутыли из темного стекла с притертой пробкой. Пользоваться реактивом можно через 48 ч после приготовления.
3.5. Приготовление молибденовокислого аммония (реактив II, слабокислый раствор)
10 г (NH4)6 · Мо7О24 · 4Н2О растворяют в 400 мл дистиллированной воды и добавляют 7 мл концентрированной 98 %-ной серной кислоты. Раствор хранят в полиэтиленовой бутыли в темном месте. Устойчив около 3 месяцев. Пользоваться реактивом можно через 48 ч после приготовления.
3.6. Приготовление 37 %-ного раствора серной кислоты. 337 мл концентрированной 98 %-ной серной кислоты осторожно смешивают, приливая небольшими порциями к 600 мл дистиллированной воды. После охлаждения раствор доводят дистиллированной водой до 1 л.
3.7. Приготовление основного раствора двухлористого олова
1,95 г кристаллического невыветренного SnCl2 · 2Н2O растворяют в 50 мл 13,6 %-ной соляной кислоты (18,4 мл 37 %-ной НСl, не содержащей мышьяка, доводят до 50 мл дистиллированной водой). Суспензию тщательно перемешивают, хранят в склянке, покрытой внутри слоем парафина. Перед употреблением суспензию хорошо перемешивают. Суспензия может быть применена непосредственно после приготовления.
3.8. Приготовление рабочего раствора двухлористого олова. 2,5 мл основного раствора (суспензия) доводят дистиллированной водой до 10 мл.
Необходимо применять свежеприготовленный раствор. Раствор устойчив около 4 ч.
4. Проведение анализа
4.1. Определению мешают железо при концентрации, превышающей 1 мг/л, растворимые силикаты более 25 мг/л, нитриты. Влияние железа и силикатов устраняется соответствующим разбавлением исследуемой воды. Влияние нитритов при концентрации до 25 мг/л устраняется добавлением к пробе 0,1 г сульфаминовой кислоты NH2SO2OH, которая вносится до добавления к пробе молибденовокислого аммония.
4.2. Определение ортофосфатов
К 50 мл исследуемой воды (без разбавления можно определить не более 0,4 мг/л РО3-4), профильтрованной через плотный бумажный фильтр (синяя лента), вносят те же реактивы и в той же последовательности, что и в образцовые растворы. Оптическая плотность раствора определяется электрофотоколориметром. Концентрация ортофосфатов устанавливается по калибровочному графику.
4.3. Определение полифосфатов
К 100 мл исследуемой воды, профильтрованной через плотный бумажный фильтр, или к меньшему объему, доведенному до 100 мл дистиллированной водой, добавляют 2 мл 37 %-ного раствора серной кислоты и кипятят 30 мин. Объем исследуемой воды поддерживают добавлением дистиллированной воды в пределах 50 - 90 мл. После охлаждения раствора переносят его в мерную колбу вместимостью 100 мл и доводят объем дистиллированной водой до метки. Добавляют 1 мл слабокислого раствора молибденовокислого раствора (реактив II), перемешивают и через 5 мин приливают 0,1 мл рабочего раствора двухлористого олова, затем снова перемешивают. Через 10 - 15 мин измеряют интенсивность окраски электрофотоколориметром.
4.4. Построение калибровочного графика
В мерные колбы вместимостью 50 мл вносят пипеткой 0,0; 0,5; 1,0; 2,0; 5,0; 10,0; 20,0 мл рабочего стандартного раствора фосфорнокислого калия (1 мл - 0,001 мг РО3-4)и доводят объем раствора до метки дистиллированной водой. Содержание полифосфатов в образцовых растворах будет соответственно равно: 0,0; 0,01; 0,02; 0,04; 0,10; 0,20; 0,40 мг РО3-4 в 1 л воды. В каждую колбу добавляют точно 1 мл молибденовокислого аммония (реактив I, кислый раствор), перемешивают и через 5 мин микропипеткой вносят 0,1 мл рабочего раствора двухлористого олова и перемешивают. Интенсивность окраски измеряют через 10 - 15 мин фотоэлектроколориметром, пользуясь красным светофильтром (l = 690 - 720 нм) и кюветами с толщиной слоя 2 - 3 см. Из полученных величин оптических плотностей вычитают оптическую плотность контрольной пробы и результаты наносят на график.
5. Обработка результатов.
5.1. Содержание неорганических растворенных ортофосфатов (X), мг/л, определяют по формуле

где C - содержание ортофосфатов, найденное по калибровочному графику, мг/л;
50 - приведение объема исследуемой воды к 50 мл;
V - объем исследуемой воды, взятый для определения, мл.
5.2. Содержание гидролизирующихся полифосфатов (X 1), мг/л, определяют по формуле
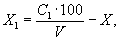
где С 1 - содержание полифосфатов, найденное по калибровочному графику, мг/л;
100 - приведение объема исследуемой воды к 100 мл;
V - объем исследуемой воды, взятый для определения, мл.
Допустимое расхождение между повторными определениями полифосфатов - 0,01 мг/л, если содержание их не превышает 0,07 мг/л, при более высоком их содержании - 15 % отн.
Контрольные вопросы и задачи.
1. Основные антропогенные и природные источники биогенных элементов
2. Негативное влияние избытка биогенных элементов на биоту
3. Опишите основные механизмы взаимодействия атмосферы, гидросферы и литосферы с процессами, происходящими в почве.
4. Перечислите распространенные формы существования элементов в земной коре.
5. Как на основании термодинамических данных оценить растворимость минералов в воде? Какие критерии устойчивости минералов
вы знаете?
6. Какие анионы и кантоны, содержащиеся в природных водах, называют главными? Почему? Какие природные источники поступления главных ионов в подземные воды вы знаете?
7. Как на основании термодинамических данных оценить растворимость минералов в воде? Какие критерии устойчивости минералов вы знаете?
8. Что такое «агрессивность» природных вод?
9. Что такое «неустойчивость» минералов?
10. Для каких целей удобно использовать понятия: а) «агрессивности»
природных под б) «неустойчивости» минералов?
11. В чем различие понятий «произведение растворимости» и «константа равновесия процесса растворения»?
12. Какую величину — произведение растворимости или константу равновесия процесса растворения — можно рассчитать на основании термодинамических данных? Какие термодинамические данные необходимы для выполнения этого расчета?
13. Как связаны между собой значения произведения растворимости и константы равновесия процесса растворения?
14. От каких физико-химических параметров системы зависит значение а) произведения растворимости; 6) константы равновесия процесса растворения?
15. Какие факторы, характеризующие природные системы, следует принимать во внимание при оценке константы равновесия процесса растворения?
16. Охарактеризуйте основные источники и пути трансформации соединений фосфора в почвах.
17. Какие глобальные проблемы связаны с чрезмерным использованием азотных удобрений? Приведите уравнения соответствующих химических реакций.
Методический инструментарий преподавателя:
-активные формы: фронтальный опрос.
Средства контроля: Тест № (см. фонд оценочных средств)
Содержание внеаудиторной работы бакалавра при подготовке к занятию
1. Владеть содержанием вопросов (по лекции).
2. Подготовить вопрос фиксации азота растениями (объем, условия, реакции, проблемы).
3. Подготовиться к диагностической самостоятельной работе в форме опроса и теста
4. Изучить термины по данной теме
Литература
1. Голдовская Л.Ф. Химия окружающей среды. - М.: МИР, 2005. - 294 с. (Библиотека УлГПУ)
2. Гусакова Н.В. Химия окружающей среды: учебное пособие для вузов. - Ростов на Дону: Феникс, 2004. - 84 с. (Библиотека УлГПУ)
3. Голицын А.Н. Промышленная экология и мониторинг загрязнения природной среды. - М.: ОНИКС, 2010. - 336 с. (Электронный ресурс.- Режим доступа: http://www.knigafund.ru/books/42468)
4. Хентов В.Я. Химия окружающей среды для технических вузов: учеб. пособие. - Ростов на Дону: Феникс, 2005. – 141 с. (Библиотека УлГПУ)
5. Тарасова Н. П. Химия окружающей среды. Атмосфера: учеб. пособие для вузов. - М.: Академ.книга, 2007. - 227 с. (Библиотека УлГПУ).
Лабораторная работа № 7 (2 часа)
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1021; Нарушение авторских прав?; Мы поможем в написании вашей работы!