
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
N электролитическая диссоциация и ионное произведение воды
|
|
|
|
Отдавая протон, кислота превращается в основание, которое называют сопряженным этой кислоте
Слабая сопряж. к-та сопряж. основание
В 1923 г. И. Бренстед и Т. Лоури предложили общую протолитическую теорию кислот и оснований.
Кислота - молекула или ион, способные отдавать катион водорода (протон). Кислота - донор протонов.
СН3СООH «H+ + СН3СОО–
Основание — молекула или ион, способные присоединять катион водорода (протон). Основание - акцептор протонов.
ОН- + Н+ = Н2О NH3 +Н+= = NH4+
А мфолиты — молекулы или ионы, способные как отдавать, так и присоединять протон, а следовательно, вступать в реакции, характерные как для кислот, так и для оснований
Н2О + НС1 = Н3О+ + СГ
Н2О + NH3 = NH4+ + ОН-
Амфолитами являются
=====гидроксиды некоторых металлов (Zn, Al, Pb, Sn, Cr):
====гидроанионы многоосновных кислот, например НСОз-, НРО4 2-.
====соединения, молекулы которых содержат две различные кислотно-основные группы, H2N—CHR—СООН
n Н2О «Н+ + ОН–
n Константа диссоциации воды при 25°С равна:
n В 1 литре воды содержится 1000/18=55,6 молей
n [Н+] ·[ОН–] = = К ·[Н2О] = 1,8 · 10–16 · 55,6 = 10–14 моль/л = KW,
n где KW — ионное произведение воды.
n Если концентрации [Н+] и [ОН–] равны, что соответствует нейтральному раствору, то [Н+] = [ОН–] = 10–7 моль/л.
Водородным показателем называют величину, численно равную отрицательному десятичному логарифму активности [или концентрации] водородных ионов и выраженную в грамм-ионах на литр или в молях на литр.
• lg KW = lg[Н+] + lg[ОН–] = lg 10–14
• Беря логарифмы с обратным знаком, получим:
• рН + рОН = 14
• Следовательно, рН и рОН являются сопряжёнными величинами: если рН = 3, то рОН = 14 – 3 = 11.
• рН крови = 7,3-7,4
• рН желудочного сока = 0,9-1,5 [взр.],
• =======новорожденных — 7,0;
• ========у детей 4-7 лет — 2,5;
• ======== у детей 14 лет — 2,0
•
• рН слюны = 7,3-7,9
n Методы определения рН растворов.
n Для определения рН растворов используют
n ---- индикаторный - применяется в том случае, когда необходимо быстро и приблизительно оценить рН исследуемого раствора.
n нельзя определить рН мутных и окрашенных растворов. Ионометрический метод позволяет определить этот показатель с. большей точностью (0,01 ед. рН).
n можно определить рН мутных, окрашенных и любых других водных растворов
n
n
n
n Активную кислотность можно определить четырьмя способами:
n 1. Кондуктометрический.
n 2. Титриметрический - с индикатором диметиламидоазобензолом ограничен, т.к. применим только к растворам сильных кислот, где концентрация ионов водорода достаточно высока, например, в желудочном соке.
n 3. Потенциометрический — наиболее современный, точный и универсальный метод определения активной кислотности
n 4. Колориметрический [colour — цветной].
n == позволяют определить рН с точностью до 0,1.
n ==только для бесцветных, прозрачных, слабомутных и слабоокрашенных жидкостей,.
• рН буферных смесей.
• Кислый буфер
• СН3СООH «H+ + СН3СОО–
 | |||
 |
• Прологарифмируем и получим уравнение Гендерсона-Гассельбальха:
• рН = рКа + lg [акцептор протона]
[донор протона]
• рН = рКа + lg [соль]
[кислота
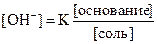 |
• Основной буфер -NH4ОН + NH4C1
•
•
•
•
•
•
• рOН = рКВ + lg [соль]
[основание
• Общий механизм действия буферных растворов
• НА «Н+ + А–
• а/ А– + Н+ ® НА [при добавлении сильной кислоты]
• б/ НА + ОН– ® Н2О + А– [при добавлении щелочи]
• Рассмотрим этот механизм на примере ацетатного буфера.
• а/ При добавлении HCl происходит взаимодействие с СН3СООNa:
• СН3СООNa «СН3СОО– + Na+
• СН3СОО– + Na+ + H+ + Cl– ® Na+ + Cl– + СН3СООН
• б/ При добавлении щелочи:
• СН3СООН + Na+ + OH– ® СН3СОО– + Na+ + Н2О
 |
• При разбавлении буферных растворов
•
•
• концентрации всех компонентов уменьшаются.
• Но так как они изменяются одинаково, то их отношение остается неизменным.
• Величина константы диссоциации слабого электролита также не изменяется при разведении.
• Буферной емкостью (В) называется число моль-эквивалентов сильной кислоты или щелочи, которые нужно добавить к 1 литру буферного раствора, чтобы изменить величину рН на единицу.
 | |||
 |
• Сыворотка крови– Вк = 0,025 моль/л
• Плазма крови – Вк= 0,03 моль/л
• Кровь – 0.05 моль/л
• Какие факторы определяют буферную ёмкость?
• 1. Наибольшей буферной ёмкостью обладают концентрированные буферные растворы,.
• 2. Из двух буферных растворов с одинаковой концентрацией буферная ёмкость будет больше у того раствора, у которого соотношение компонентов равно единице или близко к единице
• 3. при разбавлении рН раствора не меняется, но его буферная ёмкость падает.
Относительный вклад %
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 515; Нарушение авторских прав?; Мы поможем в написании вашей работы!