
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 8. Облік операцій з цінними паперами
|
|
|
|
План
Лекція №18-19
Тема: Монокарбонові кислоти та їх похідні.
1. Класифікація. Будова. Номенклатура. Ізомерія.
2. Методи добування.
3. Фізичні властивості.
4. Хімічні властивості:
а) реакції, що обумовлені рухомістю атомів водню;
б) реакції заміщення ОН-групи;
в) реакції в радикалі.
1. Монокарбоновими кислотами називають такі органічні сполуки, у складі молекул яких міститься одна карбоксильна група  . Кількість карбоксильних груп у молекулі карбонової кислоти визначає основність кислоти. Залежно від природи радикала, сполученого з карбоксильною групою, карбонові кислоти поділяють на насичені і ненасичені. За кількістю вуглецевих атомів у радикалі розрізняють кислоти нижчі (низькомолекулярні) і вищи (високомолекулярні).
. Кількість карбоксильних груп у молекулі карбонової кислоти визначає основність кислоти. Залежно від природи радикала, сполученого з карбоксильною групою, карбонові кислоти поділяють на насичені і ненасичені. За кількістю вуглецевих атомів у радикалі розрізняють кислоти нижчі (низькомолекулярні) і вищи (високомолекулярні).
Насич
ені монокарбонові кислоти мають загальну формулу 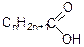 або
або  , де R – відповідний вуглеводневий радикал або атом водню, і утворюють гомологічний ряд.
, де R – відповідний вуглеводневий радикал або атом водню, і утворюють гомологічний ряд.
Н-СООН – мурашина кислота, метанова кислота
СН3-СООН – оцтова кислота, етанова кислота
СН3-СН2-СООН – пропіонова кислота, метилоцтова кислота
СН3-(СН2)2-СООН – масляна, етилоцтова, бутанова кислота
СН3-(СН2)3-СООН – валеріанова, пропилоцтова, пентанова кислота
С15Н31СООН – пальмітинова, гексадеканова кислота
С17Н35СООН – стеаринова, октадеканова кислота
Номенклатура. Карбонові кислоти називають за систематичною та історичною номенклатурами. За систематичною номенклатурою назву кислот утворюють з назв відповідних насичених вуглеводнів, даючи до них закінчення – ова і слово кислота. Головний ланцюг у молекулі кислоти вибирають так, щоб у нього обов’язково входила карбоксильна група. Положення радикалів у вуглеводневому ланцюзі позначають цифрами. Нумерацію ланцюга починають з атома вуглецю карбоксильної групи. Наприклад, кислота будови  має назву 2,4-диметилпентанова.
має назву 2,4-диметилпентанова.
Для найпоширеніших карбонових кислот широко використовують історичні назви, такі як мурашина, оцтова, масляна, валеріанова кислота тощо. Ці назви пов’язані переважно з тими джерелами, з яких була виділена та чи інша кислота: мурашина – з мурашок, оцтова – з оцту, масляна – з масла.
У деяких випадках для назви кислот нескладної структури застосовують раціональну номенклатуру, в якій за основу назви беруть оцтову кислоту. Наприклад, 2-метилпропапанову кислоту (ізомасляну) за цією номенклатурою називають диметилоцтовою.
Групу атомів  – в молекулах монокарбонових кислот називають ацилатною групою. Назви ацилатних груп монокарбонових кислот такі:
– в молекулах монокарбонових кислот називають ацилатною групою. Назви ацилатних груп монокарбонових кислот такі: 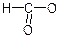 - форміат,
- форміат,  - ацетат,
- ацетат, 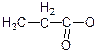 - пропіонат.
- пропіонат.
Групу атомів 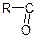 – називають ацилон.
– називають ацилон.
Ацильні групи кислот мають такі назви:  – ацил;
– ацил;  – ацетил.
– ацетил.
Ізомерія. Монокарбоновим кислотам насиченого ряду властива ізомерія, пов’язана з розгалуженням вуглецевого ланцюга. Перші 3 представники гомологічного ряду цих кислот ізомерів не мають. Кислота з чотирма вуглецевими атомами – масляна – існує у вигляді двох ізомерів – Н-масляної та ізомасляної, валеріанова – у вигляді чотирьох ізомерів. При збільшенні кількості вуглецевих атомів у молекулі карбонової кислоти кількість ізомерів різко збільшується.
Також властива ізомерія положення функції; ізомерія карбонового скелету та геометрична (просторова) ізомерія.
Класифікація. 1) Ненасичені:
1) СН2 = СН-СООН – акрилова (пропанова)
2) СН3-СН = СН-СООН – протонова
3) СН2 = СН-СН2-СООН – вінілоцтова
кислоти (1) та (2) – гомологи
(2) та (3) – ізомери
4) 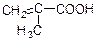 - метакрилова (2-метилпропенова)
- метакрилова (2-метилпропенова)
2) Вищі жирні карбонові кислоти:
С17Н33СООН – олеїнова кислота (1 подвійний зв’язок);
С17Н31СООН – лінолова кислота (два подвійних зв’язки);
С17Н29СООН – ліноленова кислота (три подвійних зв’язки);
С19Н29СООН – арахідонова кислота (чотири подвійних зв’язки).
Для таких кислот характерна структурна ізомерія (ізомерія вуглеводневого скелету і ізомерія положення подвійного зв’язку) і геометрична ізомерія (цис-, транс-ізомерія).
3) Ароматичні кислоти (карбоксильна група, з’єднана з фенольним радикалом):
С6Н5СООН – бензойна кислота
Радикал бензойної кислоти С6Н5СО називається бензоїлом.
Серед ненасичених ароматичних кислот:
С6Н5-СН = СН-СООН – корична кислота.
Вона існує у вигляді двох геометричних ізомерів.
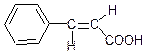

транс-корична цис-корична
2. Методи добування:
1) гідроліз складних естерів:
2) окислення алкенів (подвійний зв’язок розривається):
- оксосинтез
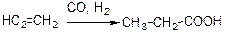
3) окислення спиртів:
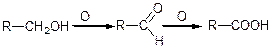
При окисленні первинних спиртів і альдегідів отримують кислоти з тією ж кількістю атомів вуглецю в молекулі:
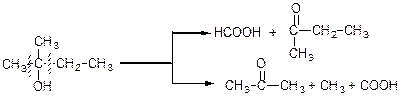
При окисленні третинних спиртів та кетонів отримують суміш карбонових кислот (2 напрямки);
4) гідроліз тригалогенпохідних:

5) з моногалогенпохідних:
а) нітрильний синтез:

б) взаємодія з магнійорганічними сполуками:

6) окислення насичених вуглеводнів:
Насичені карбонові кислоти:
1) дегідратація оксикислот:

2) дегідрогалогенування галогенпохідних кислот:

Вищі жирні кислоти отримують гідролізом жирів:
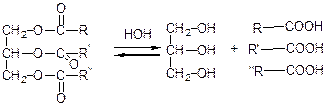
Бензойна кислота:
1) окислення алкілбензолів:

2) гідроліз тригалогенпохідних:
3. Фізичні властивості. Перші 4 члени гомологічного ряду кислот –безбарвні рухомі рідини, які розміщуються з водою в будь-яких співвідношеннях і розчиняються в деяких малополярних органічних розчинниках. Кислоти з кількістю вуглецевих атомів від С5-С10 – маслянисті рідини. Починаючи з С10 і вище – тверді малолітні парафіноподібні речовини. Зі збільшенням молекулярної маси розчинність у воді падає, збільшується розчинність у органічних розчинниках. Перші три представники мають різкий запах; середні члени – неприємний запах; вищі – запаху не мають. Температура кипіння збільшується зі збільшенням молекулярної маси.
Кислоти нормальної будови киплять при більш високій t0, ніж ізобудови фізичні властивості карбонових кислот значною мірою визначаються ступінню їх дисоціації в наслідок утворення водневих зв’язків.
Водневі зв’язки карбонових кислот значно сильніші, це пов’язано поляризацією карбоксильної групи. Зв’язки ОН-групи більш поляризовані та більш виражені кислоти мають вищі t0кип і t0пл, ніж у спиртів.
У твердому та рідкому стані карбовані кислоти не асоційовані:
 димери.
димери.
Перші представники НСООН, СН3СООН існують у вигляді ланцюгів (мають невеличку масу). Ідентифікацію карбонових кислот проводять за фізико-хімічними властивостями.
ІЧ-спектри: для ОН-групи валентні коливання становлять 3200-3500 см-1, для карбоксильної СО-групи: 1700-1400 см-1. Якщо кислоти асоційовані: смуга ОН-групи зміщується в область нижчих частот: 3000-2500 см-1.
МПР-спектри: протон карбоксильної групи поглинає в інтервалі 9,0-14,6 млн-1.
4. Хімічні властивості:
1) реакції, які обумовлені рухомістю атому гідрогену;
2) реакції, які перебігають за рахунок ОН-групи;
3) реакції в карбоновому скелеті.
1. Кислотні властивості кислот:
Поява кислотних властивостей зумовлена електронними ефектами карбоксильної групи:
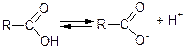
Карбоксильна група 
 являє собою поєднання карбонілу з гідроксилом -О-Н. Групи
являє собою поєднання карбонілу з гідроксилом -О-Н. Групи  і
і  в карбоксилі взаємно впливають одна на одну. Цей вплив виявляється в мезомерному ефекті р, π-спряження, в результаті якого р – електрони атома кисню гідроксилу заміщені до атома кисню карбонілу (+М-ефект):
в карбоксилі взаємно впливають одна на одну. Цей вплив виявляється в мезомерному ефекті р, π-спряження, в результаті якого р – електрони атома кисню гідроксилу заміщені до атома кисню карбонілу (+М-ефект):
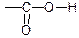
Таке заміщення електронів у карбоксильній групі приводять до підвищення полярності зв’язку О-Н і відповідно до його поставлення, а також до зменшення часткового заряду δ+ на карбонільному атомі вуглецю. В результаті атом водню в групі ОН карбоксилу стає значно активнішим, ніж в ОН-групі спиртів, і може відщеплюватися у вигляді протона Н+. Тому карбонові кислоти, на відміну від спиртів, дисоціюють у водних розчинах.
Наявність у карбоксильній групі електронегативно карбонільного атома кисню зумовлює зміщення до нього електронної густини сусідніх σ-зв’язків:
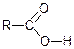
Отже, карбоксильна група в молекулах карбонових кислот виявляє негативний індукційний ефект (-І).
Кислотність залежить від радикалу (його природи та будови), наявність замісників у його вуглецевому ланцюгу.
Групи R з позитивним електронним ефектом зменшують величину часткового заряду δ+ на карбонільному С-атомі і тим самим послаблюють його електроноакцепторну дію на групу – ОН. Це приводить до послаблення сили карбонової кислоти. Тому в гомологічному ряді монокарбонових кислот мурашина кислота, в молекулі якої біля карбонільної групи немає вуглеводневого радикала з позитивним електронним ефектом, є найсильнішою кислотою. Оцтова кислота порівняно з мурашиною в 10 разів слабкіша, оскільки в її молекулі є метильний радикал, який виявляє +І-ефект. Атоми і групи атомів з негативним електронним ефектом збільшують величину заряду δ+ на карбонільному С-атомі і тим самим посилюють електроноакцепторну дію карбонілу на групу ОН. Це зумовлює значне підвищення сили карбонової кислоти. Тому хлороцтова кислота приблизно в 20 разів сильніша, ніж оцтова.
Отже, групи R з позитивним електронним ефектом зменшують, а з негативним електронним ефектом – підвищують силу карбонових кислот.
 дисоціація зменшується
дисоціація зменшується
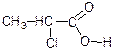 дисоціація збільшується
дисоціація збільшується
В міру віддалення замісника з -І-ефектом від карбоксильної групи його вплив на цю групу послаблюється (затухає).
| Кислота | Kд, 10-5 |
| НСООН | 21,4 |
| СН3-СООН | 1,76 |
| С6Н5-СООН | 6,6 |
| СlСН2-СООН | |
| Сl2СН-СООН | |
| Сl3С-СООН | 20000, 2·10-1 |
Бензойна кислота є трохи сильніша за оцтову. Сила карбонової кислоти збільшується, якщо атоми водню у α-вуглецевого атому замістити електроноакцепторними атомами або групами, наприклад хлорпохідні оцтової кислоти.
Три хлороцтова кислота по силі приблизна до сильних мінеральних кислот.

збільшується відрив протону.
 Таке розташування більш вигідне.
Таке розташування більш вигідне.
Енергетичний перерозподіл.
Утворення солей. Карбонові кислоти при взаємодії з активними металами, основами, амоніаком утворюють солі:
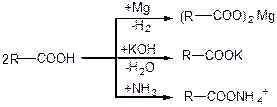
У більшості випадків солі, що утворюються, нестійкі, під дією води гідролізуються.

 RСООК+НОН RСООК+КОН
RСООК+НОН RСООК+КОН
кислота луг
Реакція можлива, кислота слабка.
Піроліз даних солей:

2. Реакції за рахунок ОН-групи.
ОН-група в карбоксильному залишку може бути заміщена різними атомами або групами, внаслідок чого утворюються речовини, які називаються функційними похідними карбонових кислот. До важливих похідних відносять: солі, ангідриди, галогенангідриди, складні ефіри, аміди, нітрили.
Утворення галогенангідридів та їх властивості. Галогенангідриди утворюються внаслідок заміщення ОН-групи на атом Наl. Як реагенти використовують хлорид фосфору (V) або тіонілхлорид.

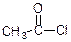
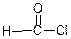 ацетил хлорид
ацетил хлорид
форміл хлорид хлористий ацетил
хлористий форміл
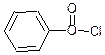
бензоїл хлорид
хлористий бензоїл
Галогенангідриди дуже реакційноздібні сполуки. Це обумовлено високою поляризацією зв’язків:
 позитивний заряд на карбоні значно збільшується.
позитивний заряд на карбоні значно збільшується.
У молекулах хлорангідридів біля вуглецевого атома, сполученого з атомом галогену, знаходиться карбонільний атом кисню, який відтягує електронну густину сусідніх зв’язків на себе. В результаті на цьому вуглецевому атомі заряд δ+ більший, ніж на атомі сполученому з атомом хлору в молекулах хлоралканів R-CH2-Cl. Відповідно полярність зв’язку хлорангідридів значно вища, ніж у хлоралканів. Тому Cl у хлорангідридах набагато реакційноздатніший і легко заміщується різними нуклеофільними реагентами. Високу активність виявляють і інші атоми галогенів.
Галогенангідриди застосовують для синтезу інших похідних кислот.
Галогенангідриди легко гідролізуються:
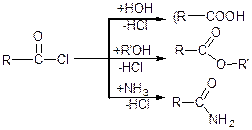
Заміщення Наl відбувається за нуклеофільним механізмом (SN-реакції).
Ці реакції можуть відбуватися за декількома механізмами: SN(1) та SN(2).
SN(1): 
реакція залежить від концентрації хлорангідриду.
SN(2): 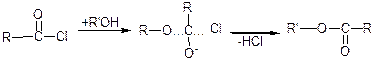
перехідний стан стабілізується.
Ця реакція залежить від концентрації хлориду та нуклеофілу.
Таким чином реакції SN відбуваються за двома механізмами:
Ангідриди кислот та їх властивості. Ангідриди кислот утворюються внаслідок відщеплення молекули води 2-х молекул кислоти за рахунок гідроксилів їх карбоксильних груп:

або (RСО)2О
Частіше отримують ангідриди при взаємодії хлорангідридів кислот з солями кислот:
Ангідриди – реакційноздатні сполуки, але дещо поступляються галогенангідридам.
Хімічні властивості:

Отримання складних естерів (етерифікація).
Складні ефіри карбонових кислот 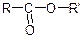 можна розглядати як продукти заміщення гідроксилу карбоксильної групи кислот на алкоксильну групу – ОR' або як продукти ацилування спиртів.
можна розглядати як продукти заміщення гідроксилу карбоксильної групи кислот на алкоксильну групу – ОR' або як продукти ацилування спиртів.
Методи отримання:
1) взаємодія спиртів з хлорангідридами або ангідридами кислот;
2) етерифікація – взаємодія карбонових кислот зі спиртами:
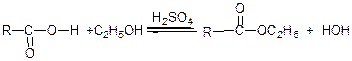
Механізм етерифікації за Фішером:
У реакції етерифікації відбувається нуклеофільне заміщення ОН-групи карбоксилу кислоти на алкоксильну групу R'О-спирту. Але у зв’язку з тим, що спирт є слабким нуклеофілом, а карбонова кислота – не сильним електрофілом, то реакція взаємодії карбонової кислоти і спирту відбувається досить повільно. Прискорюють етерифікацію кислотні каталізатори (наприклад, конц. Н2SО4).
На повільній стадії (1) до карбонільного атома кисню приєднується протон (каталізатор) і утворюється карбонієвий катіон (І), у якому значно збільшується позитивний заряд на карбонільному атомі вуглецю. На другій стадії (2) катіон (І) приєднує молекулу спирту і утворює зв'язок між карбонільним атомом вуглецю і гідроксилом спирту за рахунок вільної пари електронів його атома кисню. В результаті утворюється оксонієва сполука (ІІ), яка потім перегруповується в гідроксонієву сполуку (ІІІ), здатну відщеплювати воду і перетворюватися на карбкатіон (ІV). На останній стадії карбкатіон (ІV) відщеплює протон, який починав каталітичний процес на першій стадії, і перетворюється на кінцевий продукт етерифікації – складний ефір (V) (реакція (3)).

Назви естерів:
1) історична (за спиртовим залишком і залишком кислоти: етиловий естер оцтової кислоти, етилацетат);
2) ІЮПАК: до назви відповідного вуглеводня додають суфікс – оат: етилетаноат.
Існують інші методи добування складних ефірів:
а) взаємодія солей з галогеналкілами:

б) взаємодія спиртів (або алкоголятів) с ангідридами і галогенангідридами кислот.
Естери легко гідролізуються:
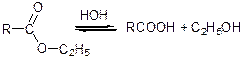
Щоб зсунути рівновагу використовують кислоти або луги (кислотний або лужний гідроліз).
Лужний гідроліз протікає швидше, ніж кислотний, оскільки нуклеофільний аніон ОН-, який атакує карбонільний атом кисню, активніший і менший за об’ємом, ніж молекули води у ході кислотного гідролізу.

реакція йде майже до кінця.
Лужний гідроліз називають омиленням складних ефірів.
Утворення амідів та нітрилів:
Аміди карбонових кислот 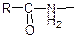 – це похідні карбонових кислот, у молекулах яких гідроксильна група карбоксилу замінена на групу –NН2, яка у складі цих речовин називається амідною.
– це похідні карбонових кислот, у молекулах яких гідроксильна група карбоксилу замінена на групу –NН2, яка у складі цих речовин називається амідною.
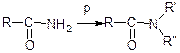
Методи добування:
1) взаємодія галогенангідридів і ангідридів кислот з аміаком;
2) взаємодія складних ефірів з аміаком;
3) при термічному розкладі амонійних солей:

Основні властивості майже не виражені; найбільше проявляються кислотні властивості. Це пояснюється участю неподіленої пари азоту в спряженні з карбоксильною групою.
Найбільш відомими є амід вугільної кислоти:
Сечовина (диамід)  використовується в якості добрива.
використовується в якості добрива.
Нітрили карбонових кислот R-C ≡ N містять CN-групу.
Отримують з амідів (при нагріванні з Р2О5 аміди втрачають молекулу води): 
Характерні реакції гідролізу:
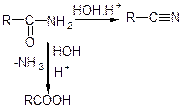
Нітрили використовують в органічному синтезі.
3. Реакції в вуглеводневому радикалі (радикали – аліфатичного або ароматичного характеру):
1) для насичених кислот:

2) для ненасичених кислот:
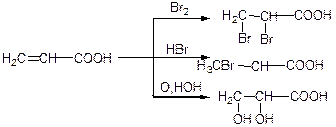
α, β – диоксимпропіонова кислота.
Велике значення мають акрилова метаакрилова кислоти; вони досить легко вступають у реакції полімеризації:
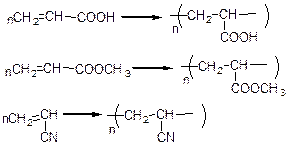
поліметаакрілати.
Нітрилакрилові кислоти мають величезне значення в сільському господарстві; поліамінокрилати утворюють органічне скло, яке в 10 разів більш кріпке силікатного.
Поліакрилонітрили утворюють різноманітні синтетичні волокна.
Ароматичними карбоновими кислотами називають похідні ароматичних вуглеводнів, що містять функціональну карбоксильну групу, яка безпосередньо сполучена з вуглецевим атомом бензольного ядра.
Найпростішим представником одноосновних ароматичних кислот є бензойна кислота С6Н5-СООН. Ароматичні кислоти утворюють гомологічний ряд.
Якщо карбоксильна група сполучена з атомом вуглецю бічного ланцюга, то такі кислоти належать до жирно-ароматичного ряду (наприклад, фенілоцтова кислота С6Н5-СН2-СООН).
Одноосновні ароматичні кислоти – кристалічні речовини, важкорозчинні в холодній воді, краще – в гарячій, добре розчиняються в полярних розчинниках. Температури кипіння і плавлення цих кислот вищі, ніж кислот аліфатичного ряду з тією самою кількістю вуглецевих атомів.
Методи добування:
1) окислення бензойного альдегіду:
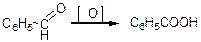
2) гідроліз бензонітрилу:

У промисловості бензойну кислоту добувають термічним окисленням толуолу киснем повітря під тиском:
1) 
2) гідроліз бензолтрихлориду:
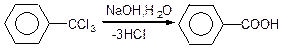
Хімічні властивості ароматичних кислот визначаються наявністю в них карбоксильної групи і ароматичного ядра.
1) Реакції з участю карбоксильної групи (наявність карбоксильної групи надає цим речовинам кислотних властивостей). У водних розчинах ароматичні кислоти дисоціюють з утворенням протонів:
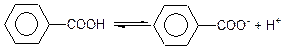
Це пояснюється впливом бензольного ядра на карбоксильну групу, яке відтягує електронну густину від карбоксилу і тим самим підкислює її кислотні властивості:

Сила ароматичних кислот залежить від природи і положення замісника в бензольному ядрі. Електронодонорні замісники, наприклад, метильна група СН3, зменшують силу цих кислот, а електроноакцепторні замісники, такі як NО2-група, збільшують силу ароматичних кислот.
а) реакції з лугами (утворюються солі): С6Н5-СООН+NаОН→С6Н5-СООNа+Н2О – бензоатнатрію;
б) взаємодія зі спиртами (утворюють складні ефіри):
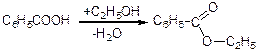
в) взаємодія з РСl5 або SOCl2 (хлорангідриди):

2) Реакції з участю ароматичного ядра. Ароматичним кислотам, як і бензолу властиві реакції електрофільного заміщення в бензольному ядрі: галогенування, нітрування, сульфування. Карбоксильна група – електрофільна і є замісником ІІ роду (мета-орієнтантом). Вона за рахунок –І-і–М-ефектів зменшує електронну густину бензольного ядра і тим самим знижує його активність до реакції SЕ.
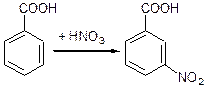
мета-нітробензойна кислота
Література
1. Степаненко Б.Н. Курс органической химии. (в 2-х частях), ч. 2. Карбоциклические и гетероциклические соединения. Учеб. для вузов. 6-е перер. и доп. М.: Высшая школа. 1981.
2. Тейлор Г. Основы органической химии для студентов нехимических специальностей./ пер. с англ. Е.Д./ М.: Мир. 1989.
3. Черных В.П., Зименковский Б.С., Гриценко И.С. Органическая химия. В 3-х томах. Харьков: Основа. 1993, 1995, 1998.
4. Домбровський А.В. Органічна хімія. Навч. посіб. – К.: Вища школа. 1991
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 395; Нарушение авторских прав?; Мы поможем в написании вашей работы!