
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Особенности растворов электролитов
|
|
|
|
Поскольку при диссоциации число частиц в растворе увеличивается, растворы электролитов обладают аномальными коллигативными свойствами.
Уравнения, описывающие коллигативные свойства неэлектролитов, можно применить и для описания свойств идеальных растворов электролитов, если ввести поправочный изотонический коэффициент i Вант-Гоффа. Например,
π = icRT (3)
или
∆Тзам = iКкm (4).
Изотонический коэффициент i связан со степенью диссоциации 
i = 1 +  (
(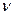 - 1) (5),
- 1) (5),
где 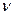 - количество ионов, образующихся при диссоциации одной молекулы. Коэффициент i для различных солей различен. С разбавлением раствора он растет, приближаясь к целым числам 2, 3, 4. Для солей аналогичного состава эти числа одинаковы. Например, для всех солей, образованных одновалентными металлами и одноосновными кислотами при достаточном разбавлении их растворов изотонический коэффициент приближается к 2, для солей образованных двухвалентными металлами и одноосновными кислотами к 3.
- количество ионов, образующихся при диссоциации одной молекулы. Коэффициент i для различных солей различен. С разбавлением раствора он растет, приближаясь к целым числам 2, 3, 4. Для солей аналогичного состава эти числа одинаковы. Например, для всех солей, образованных одновалентными металлами и одноосновными кислотами при достаточном разбавлении их растворов изотонический коэффициент приближается к 2, для солей образованных двухвалентными металлами и одноосновными кислотами к 3.
Слабые электролиты. Константа диссоциации
В растворах слабых электролитов процесс диссоциации протекает обратимо и, следовательно, к нему может быть применен закон действующих масс. Так, для процесса диссоциации уксусной кислоты можно записать
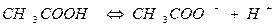 (6).
(6).
Поэтому константа равновесия КС будет равна:
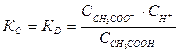 (7). Константу равновесия для процесса диссоциации называют константой диссоциации КD. Как и любая константа равновесия, константа диссоциации зависит от природы диссоциирующего вещества. С увеличением температуры КD обычно уменьшается.
(7). Константу равновесия для процесса диссоциации называют константой диссоциации КD. Как и любая константа равновесия, константа диссоциации зависит от природы диссоциирующего вещества. С увеличением температуры КD обычно уменьшается.
В соответствии с принципом Ле-Шателье температурная зависимость КD указывает на то, что процесс диссоциации является экзотермическим, то есть энергия гидратации ионов выше энергии внутримолекулярных связей.
Константа диссоциации указывает на прочность молекул слабых электролитов в данном растворе. Чем меньше константа диссоциации в данном растворителе, тем слабее диссоциирует электролит и тем, следовательно, устойчивее его молекулы.
Активность и коэффициент активности.
Свойства реальных растворов описываются уравнениями, в которых вместо концентраций вводится активность. Активность иона аi выражается в виде произведения концентрации иона сi на его коэффициент активности 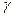 i:
i:
аi = 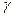 i сi (8).
i сi (8).
Экспериментально определить активности катиона а+ и аниона а- невозможно, так как они не существуют по разделности. Поэтому вводится понятие средней ионной активности а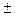 . Для электролита, образующего n+ катионов и n- анионов
. Для электролита, образующего n+ катионов и n- анионов
a± = (a+n+ ∙a-n-)1/n (9),
где n = n+ + n-.
Аналогично определяется средний ионный коэффициент активности γ±
γ± = (γ+n+ ∙γ-n-)1/n (10).

|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 517; Нарушение авторских прав?; Мы поможем в написании вашей работы!