
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кинетика процессов кристаллизации
|
|
|
|
При концентрации растворов ниже концентрации насыщения кристаллы не образуются. При концентрации выше насыщения начинается процесс кристаллизации, который можно подразделить на две стадии: образование кристаллических зародышей и их рост. Кинетика процесса кристаллизации характеризуется скоростью образования зародышей и скоростью роста кристаллов. Кристаллизацию из растворов соответственно проводят смещая равновесие в системе за счет увеличения концентрации (испарение растворителя) или за счет изменения температуры раствора (как правило – охлаждение).
Таким образом, условием проведения процесса кристаллизации является пересыщение раствора.
Пересыщенные растворы в течение некоторого времени могут не образовывать кристаллических зародышей. Продолжительность этого периода времени, называемого индукционным или латентным, зависит от природы растворенного вещества и растворителя, величины пересыщения, наличия в растворе примесей, механических и ультразвуковых воздействий и т.д. Продолжительность латентного периода может составлять от десятых долей секунды до суток и месяцев. При увеличении пересыщения сверх некоторого предела наступает процесс спонтанной кристаллизации.
Уменьшить продолжительность латентного периода можно внесением в пресыщенный раствор "затравки" - кристалликов растворенного вещества.
Для стабильного роста кристаллов зародыши должны вырасти больше некоторого, называемого критическим, размера. В противном случае зародыши могут расти, а могут и раствориться. В соответствии с тем, что при малом пересыщении (условное понятие, имеющее достаточно индивидуальные значения для каждого конкретного вещества) скорость образования зародышей равна нулю, а по мере увеличения пересыщения устойчивость системы резко падает и скорость образования зародышей растет, соответственно область пересыщения делят на две зоны: метастабильную и лабильную (Рис. 3). Граница между лабильной и метастабильной областями достаточно условна. Эта граница условно разделяет область, где вероятность спонтанной кристаллизации в течение определенного времени мала, и область, где вероятность велика.
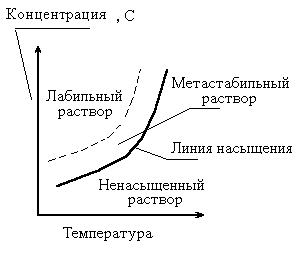
Рис..3. Лабильная и метастабильная зоны
В общем случае возникновение устойчивых кристаллических зародышей описывается выражением:
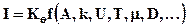 , (К.2)
, (К.2)
где I - число равновесных зародышей возникающих в единицу времени в единице объема раствора; Кq - коэффициент пропорциональности; А - работа образования зародыша; k - постоянная Больцмана; U - энергия активации; Т - температура; m - вязкость растворителя; D - коэффициент диффузии.
Единой теории механизма зародышеобразования нет. Обычно процесс зародышеобразования рассматривают как последовательное присоединение к двум ионам (молекулам) третьего и т.д. до образования зародыша критического размера. Минимальные критические размеры зародыша описываются выражением:
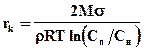 , (К.3)
, (К.3)
где rk - критический радиус; М - молекулярная масса зародыша; r - плотность зародыша; s - межфазное поверхностное натяжение; R - газовая постоянная; Cп, Cн - соответственно, концентрации пересыщенного и насыщенного раствора.
Кристаллы растут на зародышах превысивших критические размеры. Рост кристаллов происходит одновременно по всем его граням. Однако линейные скорости роста различных граней отличаются друг от друга. Единой теории роста кристаллов не существует. Нет единой теории объяснившей в целом различие в скорости роста граней, дефекты, слоистость, различие в скорости кристаллизации и растворения.
Скорость кристаллизации не является постоянной. Она меняется в зависимости от изменения условий проведения процесса. Зависимость скорости кристаллизации от пересыщения описывается уравнением:
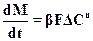 ,
, 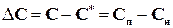 (К.4)
(К.4)
где b - кинетический коэффициент; F - площадь поверхности кристаллов; DС - абсолютное пресыщение; n - порядок процесса.
На рис. 4. показана зависимость скорости роста кристаллов от времени. Скорость кристаллизации не является постоянной, Она изменяется во времени в зависимости от условий кристаллизации в широких пределах. В начале скорость равна нулю (период индукции), потом достигает кратковременного максимума и снова уменьшается до нуля. При большой степени пересыщения раствора наблюдается резкий максимум скорости (кривая 1). При малой степени пересыщения или при наличии тормозящих кристаллизацию примесей период индукции достаточно велик и на кривой 2 наблюдается горизонтальный участок  , т.е. максимальная скорость в течение некоторого времени постоянна. Кроме пересыщения на скорость роста кристаллов сильное влияние оказывает температура. Влияние температуры строго индивидуально для каждого случая, что объясняется положительной или отрицательной растворимостью веществ. Форма кристаллов определяется природой кристаллизующегося вещества, наличия примесей в растворе, гидродинамической обстановкой в аппарате, степенью пересыщения. Размер кристаллов так же сильно зависит от степени пересыщения раствора, гидродинамической обстановки, наличия примесей (особенно присутствия поверхностно-активных веществ). Для получения крупных кристаллов применяют введение в раствор затравочных кристаллов, которые заменяют зародыши и становятся центрами кристаллизации. Фракционный состав получаемых кристаллов регулируются пересыщением раствора, созданием определенной гидродинамической обстановки или последующим разделением полученных кристаллов на фракции механическими методами. Степень чистоты получаемых кристаллов зависит от чистоты исходного раствора.
, т.е. максимальная скорость в течение некоторого времени постоянна. Кроме пересыщения на скорость роста кристаллов сильное влияние оказывает температура. Влияние температуры строго индивидуально для каждого случая, что объясняется положительной или отрицательной растворимостью веществ. Форма кристаллов определяется природой кристаллизующегося вещества, наличия примесей в растворе, гидродинамической обстановкой в аппарате, степенью пересыщения. Размер кристаллов так же сильно зависит от степени пересыщения раствора, гидродинамической обстановки, наличия примесей (особенно присутствия поверхностно-активных веществ). Для получения крупных кристаллов применяют введение в раствор затравочных кристаллов, которые заменяют зародыши и становятся центрами кристаллизации. Фракционный состав получаемых кристаллов регулируются пересыщением раствора, созданием определенной гидродинамической обстановки или последующим разделением полученных кристаллов на фракции механическими методами. Степень чистоты получаемых кристаллов зависит от чистоты исходного раствора.
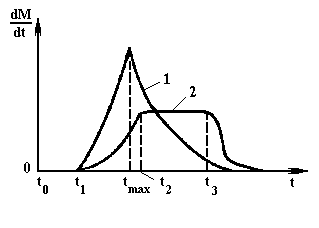
Рис. 4. Изменение скорости кристаллизации во времени:
1 - при сравнительно больших степенях пересыщения;
2 - при малых степенях пересыщения.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1762; Нарушение авторских прав?; Мы поможем в написании вашей работы!