
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Подгруппа меди
|
|
|
|
Из природных соединений меди наибольшее значение имеют минералы: медный колчедан (халькопирит) СuFеS2, медный блеск Сu2S, а также куприт Сu2О, малахит СuСО3×Сu(ОН)2 и др. Серебро входит в состав сульфидных минералов других металлов (Рb, Zn, Сd и др.). для Сu, Аg и Аu довольно обычны также арсенидные, стибидные й сульфидарсенидные минералы. Медь, серебро и особенно золото встречаются в природе в самородном состоянии.
Простые вещества. Медь, серебро и золото представляют собой металлы (соответственно красного, белого и желтого цвета) с гранецентрированной кубической решеткой. Поскольку у меди и ее аналогов в образовании связи принимают участие как n s -, так и (n—1) d -электроны, то теплоты возгонки и температуры плавления у них значительно выше, чем у щелочных металлов. Медь, серебро и золото характеризуются исключительной (особенно, золото) пластичностью; они превосходят остальные металлы также по тепло- и электрической проводимости. Некоторые константы рассматриваемых металлов приведены ниже:
Химическая активность меди и ее аналогов невелика и убывает с возрастанием порядкового номера элемента. Об этом, в частности, свидетельствуют значения энергии Гиббса образования их бинарных соединений. Металлы легче всего реагируют с галогенами (Сu при обычной температуре, Аg и Аu при нагревании).
С кислородом непосредственно взаимодействует только медь. При температуре красного каления образуется СuО, а при более высокой температуре Сu2O; с серой непосредственно взаимодействуют Сu и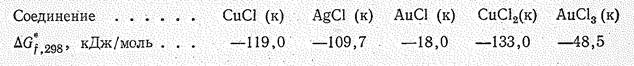 Ag:
Ag:
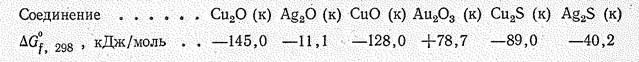 Вследствие окисления медь на воздухе покрывается плотной зелено-серой пленкой основного карбоната. При наличии в воздухе сероводорода серебро покрывается черным налетом Аg2S. С водородом медь и ее аналоги не реагируют.
Вследствие окисления медь на воздухе покрывается плотной зелено-серой пленкой основного карбоната. При наличии в воздухе сероводорода серебро покрывается черным налетом Аg2S. С водородом медь и ее аналоги не реагируют.
Об уменьшении химической активности в ряду Сu—Аg—Аu свидетельствуют также значения стандартных электродных потенциалов. Поскольку Сu, Аg и Аu расположены в ряду напряжений после водорода, кислоты могут окислять их лишь за счет аниона: Сu и Аg растворяются в НNO3 и концентрированной Н2SO4, Аu — в горячей концентрированной Н2SеO4. Лучшим растворителем для золота являются насыщенный хлором раствор НСl и царская водка. Как в том, так и в другом случае взаимодействие происходит за счет окисления Аu атомарным хлором и образования анионного комплекса:
Аu + 3Сl + НСl = Н[АuСl4]
Аu + 4НСl = Н[АuСl4] + NO + 2Н2O
В отсутствие окислителей Сu, Аg и Аu устойчивы по отношению к щелочам.
Медь и ее аналоги растворяются в растворах основных цианидов в присутствии кислорода, например:
4Аuо + O2 + 8СN- + 2Н2O = 4[Аu+1(СN)2]- + 4OН-
Медь, кроме того, в присутствии кислорода растворяется в водных растворах аммиака:
4Cu0 + O2 + 8Н3N + 2Н2O = 4[Сu(NН3)2]+ + 4OН-
Друг другом и со многими другими металлами Сu, Аg и Аu образуют сплавы. Из сплавов меди наибольшее значение имеют бронзы (90%, Сu, 10% Sn), томпак (90% Сu, 10% Zn), мельхиор (68% Сu, 30% Ni, 1 % Мn, 1% Fе), нейзильбер (65% Сu, 20% Zn, 15% Ni), латунь (60% Сu, 40% Zn), а также монетные сплавы (95% Сu и 5% Аl — разменные монеты до 5 коп, 80% Сu и 20% Ni — монеты по 10 коп. и выше).
Для получения меди применяют пиро- и реже гидрометаллургические процессы. Пирометаллургический метод основан на частичном окислении сернистых руд до оксидов меди, которые затем восстанавливаются, реагируя с избытком сульфида:
2Сu2O + Сu2S = 6Сu + SO2
Пирометаллургический процесс извлечения меди из сернистых руд типа СuFеS2 можно выразить следующей суммарной реакцией:
2СuFеS2 + 5O2 + 2SiO2 = 2Сu + 2Fе SiO3 + 4SO2
Для отделения меди от железа и пустой породы медную руду обжигают на воздухе. При этом сульфиды железа переходят в FеО и выделяется SO2. Затем к образовавшемуся огарку добавляют кремнезем и кокс; шихту направляют на плавку. При плавлении шихты образуются две жидкие фазы. Верхний слой — сплав оксидов и силикатов (шлак), в который переходит часть железа (в виде FеSiO3) и компонентов пустой породы. Нижний — сплав сульфидов (штейн), в котором концентрируется медь (в основном в виде Сu2S×FеS) и сопутствующие ей ценные элементы (Аu, Аg, Sе, Те, Ni и др.). Далее жидкий штейн подвергают окислительному обжигу, пропуская через него сжатый воздух. При этом происходит дальнейшее выгорание серы, переход железа в шлак и выделение металлической меди:
2(Сu2S×FеS) + 5O2 + 2SiО2 = 4Сu + 2FеSiО3 + 4SO2
Образующийся при пирометаллургической переработке руды SO2 идет на производство серной кислоты, а шлак используется для производства шлакобетона, каменного литья, шлаковаты и пр. Получаемая пирометаллургическим методом медь обычно содержит 95—98 % Сu. Для получения меди высокой степени чистоты проводится электролитическое рафинирование электролизом СuSO4 с медным анодом. При этом сопутствующие меди благородные металлы, селен, теллур и другие ценные примеси концентрируются в анодном шламе, откуда их извлекают специальной переработкой.
Гидрометаллургические методы получения меди основаны на селективном растворении медных минералов обычно в разбавленных растворах Н2SО4 или аммиака. Из полученных растворов медь вытесняют железом либо выделяют электролизом.
Для отделения самородного золота от пустой породы применяют промывку водой, растворение Аu в жидкой ртути с последующей разгонкой амальгамы. Лучшим методом отделения золота от пустой породы является цианидный метод. Этот метод основан на растворении Аu в растворе NаСN за счет окисления кислородом воздуха и перехода в анионный комплекс Nа[Аu(СN)2] с последующим вытеснением из цианоаурата (I) цинком:
2Nа[Аu(СN)2] + Zn = Nа2[Zn(СN)4] + 2Аu
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 544; Нарушение авторских прав?; Мы поможем в написании вашей работы!