
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Поляризация
|
|
|
|
Поляризация – это изменение потенциалов электродов при протекании электрического тока.
Виды поляризации:
1) Химическая - возникает в результате выделения на электродах веществ и образования химического гальванического элемента.


2) Концентрационная поляризация – возникает в результате различного изменения концентрации электролита у анода и катода и образования концентрационного гальванического элемента.


В результате разложение электролита может происходить, если приложенное напряжение больше, чем ЭДС гальванического элемента, соответствующего обратному процессу.
Введем определения:
Напряжение разложения – это разность потенциалов между электродами, при которой происходит электролиз данного вещества.  .
.
Потенциал разрядки (потенциал выделения) – это потенциал электрода, при котором на нем происходит разрядка данного иона φразр.
Очевидно, что напряжение разложения равно разности потенциалов разрядки
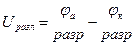
Перенапряжение – это разность между Uразл и ЭДС гальванического элемента, соответствующего обратному процессу.
Uразл = Е + η
Общее перенапряжение складывается из перенапряжений на электродах:
η = ηа+ ηк
Тогда потенциалы разрядки


Перенапряжения выделения металлов невелики и ими часто можно пренебречь. Напротив, перенапряжения выделения газов велики и сильно зависят от материала электродов, состояния их поверхностей и др. факторов.
Порядок разделения ионов на электродах
При постепенном увеличении напряжения на электродах на катоде в первую очередь начинают разряжаться ионы с более положительным потенциалом разрядки.
Приближенный порядок разрядки на аноде:
1. Анионы безкислородных кислот Cl-, Br-, I-
2. OH-
3. H2O
4. NO3-, SO42- и т.д.
Пример: на катоде безводного раствора ZnSO4 может выделяться либо Zn, либо H2 . φZn разр.≈ φравнов и составляет -0,76 В. 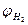 складывается из потенциала равновесного для нейтрального раствора φравн = -0,228 В и перенапряжения выделения Н2 на Zn η к = 0,78 В. В итоге потенциал разрядки Н2 φразр = -0,928 В, выделяется Zn. На аноде будет выделяться О2 из воды. График зависимости силы тока от потенциала электрода называется поляризационной кривой. Поляризационная кривая применяется для анализа раствора смеси электролитов полярографическим методом.
складывается из потенциала равновесного для нейтрального раствора φравн = -0,228 В и перенапряжения выделения Н2 на Zn η к = 0,78 В. В итоге потенциал разрядки Н2 φразр = -0,928 В, выделяется Zn. На аноде будет выделяться О2 из воды. График зависимости силы тока от потенциала электрода называется поляризационной кривой. Поляризационная кривая применяется для анализа раствора смеси электролитов полярографическим методом.
Причины возникновения перенапряжения водорода.
Процесс выделения водорода на катоде состоит из следующих стадий:
1. Подвод ионов водорода к поверхности катода (диффузия)
2. Разряд ионов на поверхности катода
3. Образование молекул водорода из атомов.
4. Объединение молекул водорода в пузырьки и отрыв от катода
Причиной возникновения перенапряжения может быть либо малая скорость второй стадии (теория замедленного разряда), либо третей стадии (адсорбционная теория перенапряжения).
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 378; Нарушение авторских прав?; Мы поможем в написании вашей работы!